编者按:
腺相关病毒(AAV)发展的最新进展产生了工程化衣壳,能够比自然产生的衣壳更有效地转导中枢神经系统(CNS)中定义明确的细胞群。AAV载体作为一个快速且灵活在体内实现基因稳定表达的手段,与目前的遗传学调控技术相结合,能极大的推进神经科学的变革。但是目前对于CNS病毒衣壳的研究主要集中在神经元和胶质细胞,对于特异性调节非神经元细胞的病毒衣壳的研究仍进展缓慢。
脑血管内皮细胞是表达在血管腔隙的一类中枢非神经元细胞群体,作为血脑屏障的重要组成部分,调节许多关键的生理过程。此外,内皮细胞在神经系统功能中起着至关重要的作用,越来越多的证据表明内皮细胞损伤是导致各种神经系统疾病的主要原因。毛细血管内皮细胞能通过调节细胞物质转运维持血脑屏障的完整性,而静脉内皮细胞似乎在神经免疫通讯中扮演重要角色。但是目前对于内皮细胞有限的研究手段阻碍了对内皮细胞功能进行具体而深入的研究。
到目前为止,只有两种病毒载体被认为能够有效在脑血管内皮细胞中表达,即AAV-PHP.V1和AAV-BR1,但是这两类病毒都存在明显的局限性。AAV-PHP.V1对感染的内皮细胞没有选择性,并且对于星形胶质细胞也有较高的趋向性。相比之下,AAV-BR1感染脑微血管内皮细胞具有相对的特异性,但该载体在动脉和静脉血管内皮细胞的表达效率仍不清楚,并且最近研究发现,AAV-BR1在一些较大的血管节段的内皮细胞表达效率很低。
因此,小编在这里给大家推荐哈佛医学院神经生物学顾成华教授联合美国麻省理工学院、哈佛大学博德研究所Benjamin E. Deverman教授发表于《nature cardiovascular research》的研究论文“A high-efficiency AAV for endothelial cell transduction throughout the central nervous system”。作者研发出一类AAV9工程化的病毒衣壳—AAV-BI30,这是一种在中枢神经系统中特异而高效地转导内皮细胞的衣壳。在相对较低的全身剂量下,该载体可转导成年C57BL/6小鼠大脑、视网膜和脊髓脉管系统中的大多数动脉、毛细血管和静脉内皮细胞。此外,研究人员还表明AAV-BI30在体内对多种小鼠品系和大鼠内皮细胞,在体外对人脑微血管内皮细胞都有较强的转导能力,可实现跨物种的特异性表达。最后,作者还证明了AAV-BI30在中枢神经系统中实现高效和内皮特异性Cre介导的基因操纵的能力。这使得AAV-BI30非常适合解决神经血管生物学中突出的研究问题,有利于加深对正常生理中神经血管相互作用的认识,以及开发相关中枢疾病中治疗内皮功能障碍的药物。
一、AAV-BI30在小鼠和大鼠脑微血管内皮细胞中有效表达
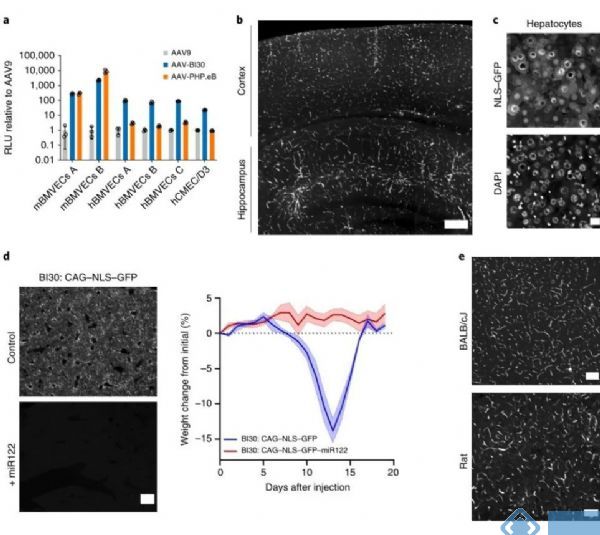
为了开发出具有高效感染中枢神经系统内皮细胞能力的病毒衣壳,研究人员构建出一个AAV9衣壳文库,希望能从中筛选出有效地感染人和小鼠内皮细胞的病毒衣壳。该文库构建基于重组AAV的骨架AAV9-CMV-Express进行筛选,在感染的细胞中表达病毒衣壳基因,通过对病毒衣壳的mRNA进行测序,筛选出不同类型的病毒衣壳。通过两轮筛选,发现AAV-BI30在各物种的脑微血管内皮细胞中具有较高的感染效率,并且在较低病毒剂量(1×1011 vg/每只)的情况下实现了在小鼠和大鼠的脑微血管内皮细胞的有效表达。
但是AAV-BI30对于肝细胞有较高的趋向性,并且导致肝细胞的形态异常。为了降低AAV-BI30对肝细胞的损伤,研究人员在病毒中加入肝特异性的miR-122重复序列,该载体在降低病毒肝脏趋向性的同时,保留了脑微血管内皮细胞的特异性表达。
为了研究AAV-BI30在脑微血管内皮细胞中的感染效率,研究人员设计了一种特殊的分析方案,即通过病毒的NLS-GFP和内皮特异性转录因子ERG的共定位来评估AAV-BI30的感染效率,该方案能快速识别出脑血管的单个内皮细胞。通过与AAV-BR1的对比,发现两类病毒均有明显的脑微血管内皮细胞的趋向性,但是AAV-BI30在微血管内皮细胞的感染效率明显优于AAV-BR1。
图1. AAV-BI30在小鼠和大鼠脑血管内皮细胞中有效表达
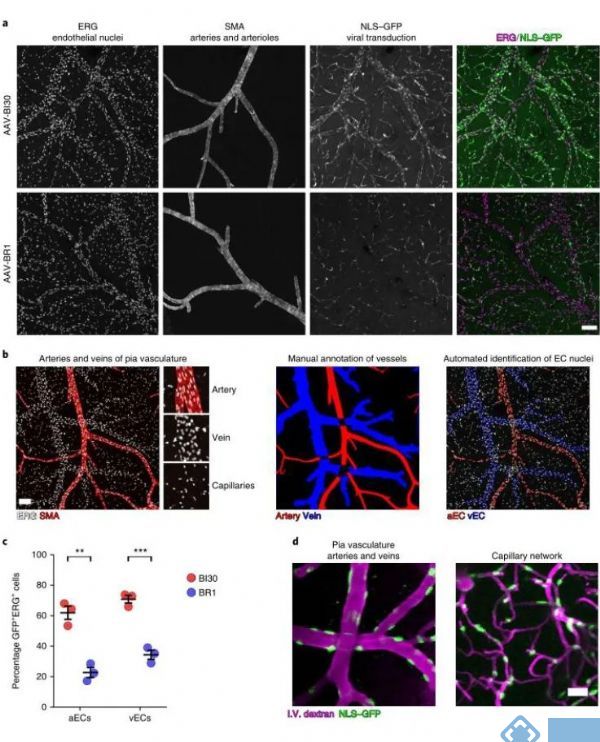
二、AAV-BI30在动脉和静脉血管内皮细胞中有效表达
接着研究人员关注AAV-BI30在动脉和静脉血管内皮细胞的表达效率,通过脑血管的冠状切面或者矢状切面可以评估AAV在毛细血管的感染效率,但该方案评估动静脉毛细血管的表达效率存在明显的局限性,因为动脉和静脉不成比例的分布导致局部切面获取的信息很有限,因此研究人员制备了完整的脑血管系统形态标记。发现AAV-BI30在62%的动脉血管内皮细胞和71%的静脉血管内皮细胞有效表达,而作为对照的AAV-BR1仅在23%的动脉血管内皮细胞和35%的静脉血管内皮细胞中表达。
为了进一步确认AAV-BI30在活体组织中的表达水平,研究人员使用在体双光子技术对AAV-BI30的表达效果进行进一步确认。研究发现AAV-BI30(剂量为1×1011 vg/每只)在活体小鼠的动脉血管、静脉血管和微小毛细血管内皮细胞中均稳定表达。因此,AAV-BI30在较低病毒剂量的情况下,就能实现脑血管内皮细胞的高效特异性表达。
图2. AAV-BI30在动脉和静脉血管内皮细胞中有效表达
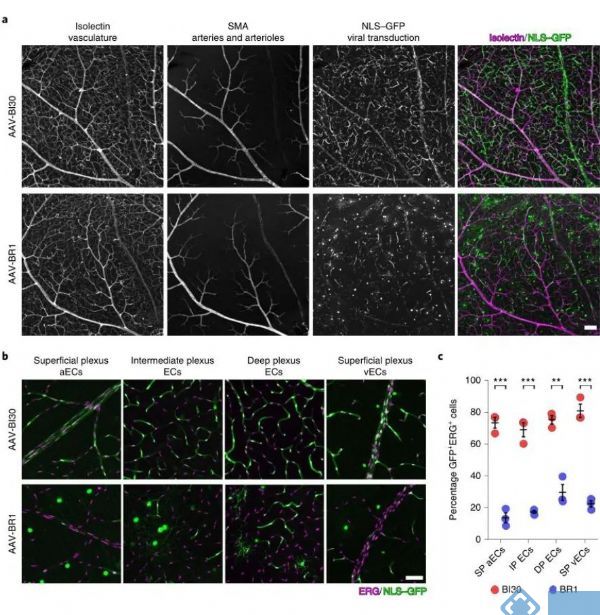
三、AAV-BI30在视网膜和脊髓的内皮细胞中有效表达
目前对于中枢内皮细胞的研究大多集中在脑血管系统,但是视网膜和脊髓的血管系统对于血管生成、血脑屏障动力学特征以及神经血管病变中均具有重要作用,因此研究人员关注AAV-BI30对视网膜和脊髓血管系统内皮细胞的标记效率。
经过比较发现AAV-BI30在视网膜内皮细胞的感染效率显著优于AAV-BR1:AAV-BI30感染了73%的浅丛动脉内皮细胞、81%的浅丛静脉内皮细胞、69%的中间丛内皮细胞和75%的深丛内皮细胞。而AAV-BR1只感染14%的浅丛动脉内皮细胞、23%的浅丛静脉内皮细胞、18%的中间丛内皮细胞和30%的深丛内皮细胞。
在脊髓血管内皮细胞中也发现AAV-BI30的感染效率显著高于AAV-BR1,AAV-BI30可以感染76%的脊髓血管内皮细胞,而AAV-BR1只能感染46%的脊髓血管内皮细胞。因此AAV-BI30内皮细胞的特异性表达不仅仅局限于脑血管内皮细胞,并且在全脑内皮细胞中均能有效表达。
图3. AAV-BI30在视网膜和脊髓的内皮细胞中有效表达
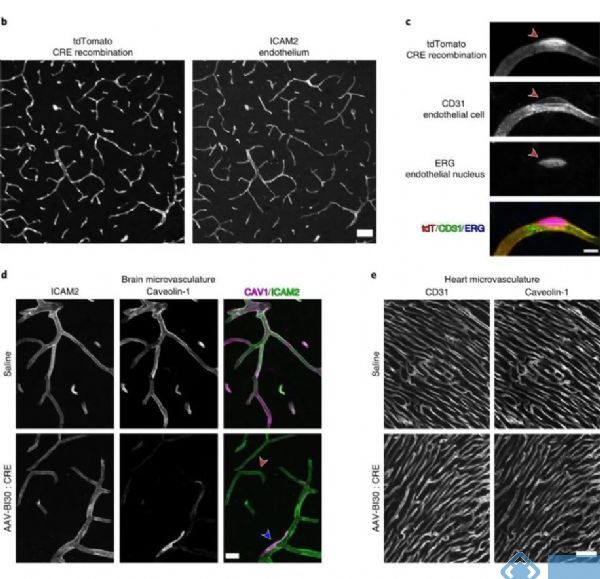
四、使用AAV-BI30对脑血管内皮细胞进行基因操纵
为了评估AAV-BI30对脑血管内皮细胞的基因操纵能力,研究人员使用Cre重组酶系统对病毒进行包装(AAV-BI30:CAG-CRE-miR122-WPRE),并在Rosa26 Cre依赖的报告小鼠进行研究。发现病毒能驱动94%的内皮细胞发生基因重组。
使用AAV-BI30对脑血管内皮细胞进行功能研究,Caveolin-1(Cav1,小窝蛋白)在维持神经血管耦合、维持血脑屏障中具有重要作用。在Cav1-loxp小鼠使用AAV-BI30的cre病毒进行重组,发现AAV-BI30能显著降低血管内皮细胞的Cav1的表达,但不会影响非血管内皮细胞的Cav1的表达。
以上结果说明AAV-BI30在脑血管内皮细胞的功能研究中具有重要的作用,在缺乏中枢内皮细胞标记的特异性转基因小鼠的研究现状面前,AAV-BI30有望成为特异性研究中枢内皮细胞功能的特异性干预手段。
图4. AAV-BI30可对脑血管内皮细胞进行基因操纵
五、总结
综上所述,本文研究人员通过构建AAV衣壳文库,筛选获得AAV-BI30,并且经过与目前唯二的脑血管标记病毒AAV-PHP.V1和AAV-BR1的对比,发现该病毒在更低的病毒剂量(1×1011vg/每只)条件下,能高效的在中枢不同类型血管内皮细胞中特异性表达,展现出了AAV-BI30在特异性研究脑血管内皮细胞功能的巨大潜力,有利于加深我们对脑血管内皮细胞生理功能的认识,有利于揭示脑血管内皮细胞在神经病理状态的变化,为研究人员早日攻克脑血管功能障碍相关的神经和精神疾病提供重要保障。
想了解更多关于AAV在血管内皮中研究的应用,请看下篇推文。
扫码下载原文
我司重磅推出环路示踪,光遗传,钙记录,膜片钳,电生理等动物实验服务!
公司相关业务:
神经环路示踪病毒载体、基因编辑(敲入、敲除、点突变、敲低)、基因过表达/干扰服务、行为学小鼠模型构建、干细胞诱导分化、整包服务等。