一、类器官介绍
类器官(organoids)指利用成体干细胞或多能干细胞进行体外三维(3D)培养而形成的具有一定空间结构的组织类似物。尽管类器官并不是真正意义上的人体器官,但能够在结构和功能上模拟真实器官,重现对应器官的部分功能,从而提供一个高度生理相关系统。类器官能够最大程度地模拟体内组织结构及功能并能够长期稳定传代培养。
目前3D类器官培养技术已经成功培养出大量具有部分关键生理结构和功能的类组织器官,比如:皮肤、心脏、肾脏、肝脏、肺、小肠、大脑、胃、胰腺、内耳等。不仅包括正常器官组织类器官,还有相应肿瘤组织类器官。
类器官培养系统主要包括基质胶、维持类器官生态所需因子和分化所需因子这几个主要元素。基质胶中含有胶原、巢蛋白和纤连蛋白等,为类器官形成三维空间结构提供基质。维持类器官生态所需因子主要目的为促进细胞的增殖和抑制细胞凋亡等。基质胶可以产生类似于哺乳动物细胞基底膜的生物活性基质材料,帮助多种类型的细胞达到附着和分化。
(Heydari Z, et al. Biodes Manuf. 2021;4(4):689-716.)
长期以来,科学家们都利用动物模型来进行疾病研究和药物开发。与二维培养和动物模型相比,类器官具有巨大的优势。类器官与2D细胞培养相比,具有更接近生理细胞组成和行为,更稳定的基因组,更适合于生物转染和高通量筛选等优势。与动物模型相比,类器官模型体外建模,操作简单,可用于研究疾病发生和发展等机理。这使其成为不同实验、建模疾病和高通量筛选的实用平台。Nature Methods如此评价类器官技术:利用干细胞直接诱导生成三维组织模型,为人类生物学研究提供了强大的方法。
(Heydari Z, et al. Biodes Manuf. 2021;4(4):689-716.)
类器官研究应用方向
类器官的研究主要集中在:神经发育,神经迁移,物种比较,脑部疾病,脑肿瘤。
(Shi Y, Wu Q, Wang X. Curr Opin Neurobiol. 2021 Feb;66:103-115.)
不同类器官中应用方向
(Heydari Z, et al. Biodes Manuf. 2021;4(4):689-716.)
二、脑类器官在脑类疾病中的研究
在过去的几年中,脑类器官系统已被广泛用于研究人类大脑疾病。由于脑类器官经历的培养与人类胎儿大脑的发育步骤相似,所以它们适用于模拟具有实际病因的神经发育障碍;同时,通过模拟脑类疾病的进展,可以实现药物的筛选。
图1. 类脑器官的发展历程(Shi Y, Wu Q, Wang X. Curr Opin Neurobiol. 2021 Feb;66:103-115.)
类脑器官的培养流程
(Shi Y, Wu Q, Wang X. Curr Opin Neurobiol. 2021 Feb;66:103-115.)
不同脑区发育的类脑器官的培养方案
(Shi Y, Wu Q, Wang X. Curr Opin Neurobiol. 2021 Feb;66:103-115.)
利用ESCs/iPSCs培养类脑器官需:
适当的起始细胞群;
一定量的生长因子;
合适的细胞外基质。
三、病毒载体在类器官研究中的应用
病毒载体在脑类器官中应用
在体外培养的hCOs(人皮层类器官)中异位表达ETV2[ETS(E-twenty six)变型2]转录因子,出现了复杂的功能性血管网络,获得与人血脑屏障十分类似的结构vhCOs(血管化人皮层类器官)。
病毒载体:慢病毒(LV-FUW-tetO-ETV2)
(Cakir B, et al. Nat Methods. 2019 Nov;16(11):1169-1175.)
vhCOs中的神经细胞不仅存活率要较control hCOs更高,而且具有功能的神经细胞数量也要比hCOs中更多。
功能方面,通过跨内皮阻抗(TEER)分析表明,第30天及第70天时的vhCOs的TEER均显著性高于hCOs,且其在三维结构上TEER阻值十分接近于人血脑屏障TEER阻值。
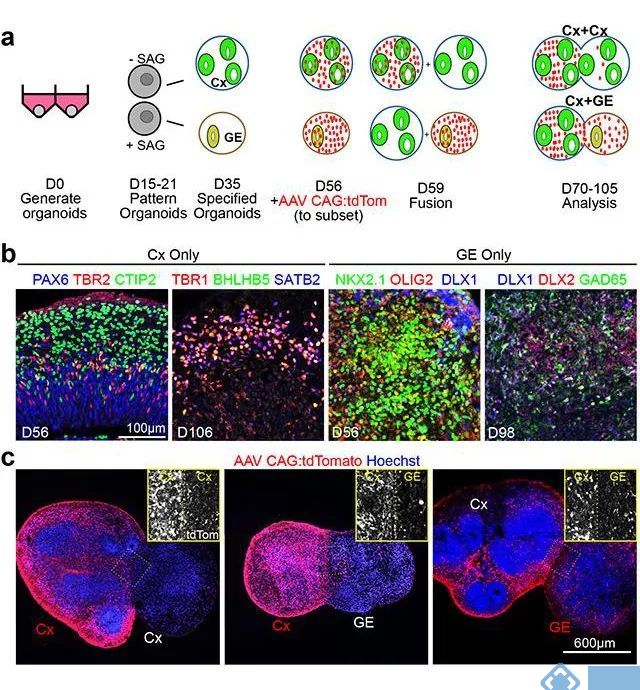
AAV介导跟踪融合脑类器官的生成
AAV1-CAG-tdTomato标记GE(神经节隆起)类器官,监测神经元迁移;AAV1-Syn-GCaMP6f-WPRE-SV40感染Cx(皮质)+GE类器官,激发钙活性[Cx和GE类器官由H9 hESC或是Rett hiPSCs细胞系产生]。
病毒载体:AAV(滴度1.98×1013 GC/mL,用量5μL)。
(Samarasinghe RA, et al. Nat Neurosci. 2021 Oct;24(10):1488-1500.)
病毒载体在眼类器官的应用
AAV介导的泪腺类器官,治疗干眼症;有助于了解眼睛生理学和模拟眼科疾病。
(Manafi N, et al. Ocul Surf. 2021 Jan;19:1-15.)
病毒载体在乳腺类器官的应用
利用慢病毒构建乳腺肿瘤类器官模型
正常乳腺组织类器官中利用慢病毒转导表达靶向P53/PTEN/RB1基因的sgRNA和Cas9酶,从而造成相应的基因敲除。
病毒载体:慢病毒(滴度5×107 pfu/mL)
P53/PTEN/RB1肿瘤抑制基因
敲除P53/PTEN的正常乳腺组织类器官添加Nutlin-3a(10μM)处理7d将杀死所有表达野生型P53的细胞,并可用于选择P53敲除的类器官。而类器官选择和克隆培养,有助于优化小鼠原位类器官移植,无需手术即可移植类器官和雌激素颗粒,帮助治疗乳腺癌。
(Dekkers JF, et al. Nat Protoc. 2021 Apr;16(4):1936-1965.)
通过免疫组化检测,与原始乳腺肿瘤标本比较发现,类器官在培养过程中有时失去ER(~25%标本,雌激素受体)、PR(~25%标本,孕酮受体)或HER2(~20%标本,人表皮生长因子受体2)表达,少数标本获得ER(~10%)或HER2(<5%标本)表达。
病毒载体在肠道类器官的应用
LV转导获得HIE敲除细胞系
人体肠道组织衍生的小肠(HIE,也称为类器官)是用于胃肠道研究的强大的离体模型。使用CRISPR–Cas9来敲除影响HuNoV(人诺如病毒)感染的基因,包括宿主附着因子基因FUT2和先天免疫基因STAT1(信号转导与转录激活因子1)。STAT1-KO HIE通过免疫印迹进行验证,该免疫印迹减缓了STAT1蛋白的损失,顶端质膜蛋白(绒毛蛋白,Villin)仍在HIE中表达并被检测为内部对照。
STAT1-KO HIE细胞更容易被GII.3(HuNoV毒株的一种)感染(Lin SC, et al. Nat Protoc. 2022 Apr;17(4):1004-1027.)
病毒载体在肠道类器官的应用
病毒载体:AAV(rAAV2/5-CMV173-CFTRΔR和rAAV2/5-CMV173-eGFP-P2A-Fluc,用量:9×10^10 GC/每只,50μL)
利用LV构建人类CFTR缺陷类器官
(Vidović D, et al. Am J Respir Crit Care Med. 2016 Feb 1;193(3):288-98.)
人类CFTR(囊性纤维化跨膜电导调节因子)缺陷类器官的rAAV-CFTRΔR转导导致毛喉素诱导的肿胀,使CFTR功能恢复。在小鼠体内通过rAAV2/5介导的CFTRΔR转导恢复了鼻粘膜中的离子转运缺陷。
类器官实验很有价值,因为它们允许使用敏感和定量的肿胀测定对CF患者衍生材料进行功能性载体评估。
病毒载体在肺类器官的应用
鉴定适用于肺芽类器官的AAV血清型
病毒载体:AAV(rAAV-CMV/hCEFI-eGFP,3.5E+8~1.0E+9 GC)
(Meyer-Berg H, et al. Stem Cell Res Ther. 2020 Oct 23;11(1):448.)
病毒载体在肝类器官的应用
选用适合肝类器官的AAV血清型
AAV-DJ载体高效转导肝导管类器官
AAV-DJ载体介导的基因操作能够剖析胆管细胞到肝细胞分化中的基因功能
用AAV-DJ-HNF4α(肝细胞核因子4α)或AAV-DJ-GFP转导肝导管类器官,然后进行肝细胞分化诱导。RNA测序显示HNF4α过表达后,肝细胞标记基因Ttr、Cyp3a11(细胞色素P450/CYP450基因,在成熟肝细胞中特异表达)、Albumin(白蛋白)表达上调。表明AAV-DJ-HNF4α极大地促进了肝细胞成熟后的胆管细胞向肝细胞的分化。
(Wei J, et al. J Biol Chem. 2019 Sep 20;294(38):14096-14104.)
在导管类器官中利用AAV-DJ载体转导16种肝细胞富含转录因子,随后进行肝细胞分化诱导。通过qRT-PCR检测肝细胞marker(Alb、Cyp3a11、Sult1a1、Mup20和 Apoa1)及胆管细胞marker(Sox9和Spp1)表达水平。从而筛选确定了HOPX(同源域特有蛋白同源框)、TBX15(T-box 15)和TFCP2L1(转录因子CP2样1)是肝细胞分化的主要调节因子。
综上所述,这种高效便捷的基因操作方法有助于研究肝谱系转变中的基因功能以及工程类器官在再生医学中的应用。
四.参考文献
[1]Heydari Z, et al. Organoids: a novel modality in disease modeling. Biodes Manuf.2021;4(4):689-716.
[2]Shi Y, Wu Q, Wang X. Modeling brain development and diseases with human cerebral organoids. Curr Opin Neurobiol. 2021 Feb;66:103-115.
[3]Cakir B, et al. Engineering of human brain organoids with a functional vascular-like system. Nat Methods. 2019 Nov;16(11):1169-1175.
[4]Samarasinghe RA, et al. Identification of neural oscillations and epileptiform changes in human brain organoids. Nat Neurosci. 2021 Oct;24(10):1488-1500.
[5]Manafi N, et al. Organoids and organ chips in ophthalmology. Ocul Surf. 2021 Jan;19:1-15.
[6]Dekkers JF, et al. Long-term culture, genetic manipulation and xenotransplantation of human normal and breast cancer organoids. Nat Protoc. 2021 Apr;16(4):1936-1965.
[7]Lin SC, et al. Generation of CRISPR-Cas9-mediated genetic knockout human intestinal tissue-derived enteroid lines by lentivirus transduction and single-cell cloning. Nat Protoc. 2022 Apr;17(4):1004-1027.
[8]Vidović D, et al. rAAV-CFTRΔR Rescues the Cystic Fibrosis Phenotype in Human Intestinal Organoids and Cystic Fibrosis Mice. Am J Respir Crit Care Med. 2016 Feb 1;193(3):288-98.
[9]Meyer-Berg H, et al. Identification of AAV serotypes for lung gene therapy in human embryonic stem cell-derived lung organoids. Stem Cell Res Ther. 2020 Oct 23;11(1):448.
[10]Wei J, et al. Gene manipulation in liver ductal organoids by optimized recombinant adeno-associated virus vectors. J Biol Chem. 2019 Sep 20;294(38):14096-14104.
如有相关实验需求,请咨询我们!
我司重磅推出环路示踪,光遗传,钙记录,膜片钳,电生理等动物实验服务!
公司相关业务:
神经环路示踪病毒载体、基因编辑(敲入、敲除、点突变、敲低)、基因过表达/干扰服务、行为学小鼠模型构建、干细胞诱导分化、整包服务等。