实时荧光定量PCR(qRT-PCR)作为一种检测mRNA的敏感方法已被广泛应用于基因的表达分析。与常规PCR相比,qRT-PCR具有精确性好、敏感性高、支持批量检测及适用广泛等优点。在利用qRT-PCR技术检测目的基因的表达水平时。为了减少检测样本在RNA产量、质量和反转录效率上可能存在的差异,需要选择合适的稳定内参基因作为校正标准,但是迄今为止尚未找到在所有条件下均可稳定表达的内参基因。近年来出现了筛选稳定性好的内参基因的新方法,如使用GeNorm软件、基因芯片据、EST数据库。
1.qRT-PCR中内参基因的意义内参基因是指其表达水平不受研究条件的影响且可以在多种样本间恒定表达的已知参照基因。用这个基因的表达水平可以准确量化初始材料的载量。由于管家基因的表达水平受环境因素影响较小,并能在生物体几乎全部组织及各个生长阶段持续表达,所以在试验中通常选用管家基因作为内参基因,然而,管家基因在部分不同组织或不同处理条件下其转录水平可能会发生变化,所以,迄今为止尚未找到理想的内参基因。目前进行qRT-PCR定量基因表达的方法主要有两类,即绝对定量法和相对定量法。
绝对定量法能够获得基因表达的准确表达量。但针对不同的目的基因,需要构建不同的标准品,大大增加试验的难度和复杂性。因此,利用qRT-PCR技术测定基因的表达量时。往往不是直接测定目的基因的绝对表达量,而是分别测定目的基因和内参基因的表达量。并把内参基因的表达量作为一个标准来测出目的基因的相对表达量,最后再进行样品间相对表达量的比较。与绝对定量法相比相对定量法简单、准确并且高效,应用十分广泛,但其需要选择合适的内参基因。
在用相对定量法测定基因的表达水平时,还需要考虑数据如何呈现。qRT-PCR得到的CT值是指数关系,不是线性关系,因此不能将CT值直接用于需要数据正态分布的统计分析方法如t检验和方差分析(ANOVA)方法中,所以统计数据时应先将原始CT值进行2-CT转换,使数据达到线性关系后再进行统计分析。在用相对定量法得到数据后,进行数据分析时常用比较CT值法(2-△△CT法)。此方法基于2个假设:①扩增效率为100%,即每个PCR循环产物的量都翻倍,可以通过扩增效率的验证来解决;②有合适的内参基因校正上样量的误差。
2.内参基因在物种及组织的表达特异性内参基因通常是各种管家基因,各类管家基因在生物体各类细胞中都表达。然而,在不同的物种及不同类型的组织中管家基因的表达也具有特异性。已有的研究结果表明,在所有组织、发育时期、生理条件下均稳定表达的理想内参基因并不存在,所以其表达的稳定性是相对的(表1),需要研究者根据自己的样品类型及试验条件来选择合适的内参基因。
表1 已报道的部分物种qRT-PCR内参基因
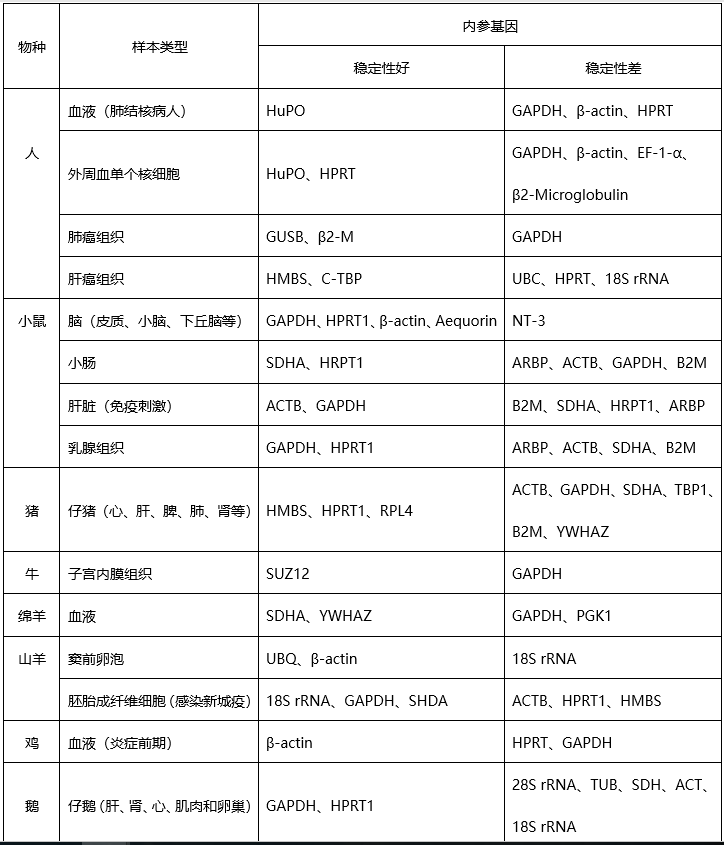
很多qRT-PCR试验只选择单一的内参基因来校正与标准化目的基因的表达,其中常用内参基因有GAPDH,β-actin、18S rRNA和28S rRNA等。
3.1 GAPDH
甘油醛-3-磷酸脱氢酶(GAPDH)是糖酵解、糖异生及光合作用过程中碳固定循环中的关键酶,是最常用的内参基因之一。但是,许多研究表明GAPDH在某些特定条件下其表达存在不稳定性。如Robert等人根据GAPDH在人类72个不同组织中的表达研究,结果显示GAPDH表达量最高的骨骼肌组织相对于表达量最低的乳房组织,其表达量竟相差了15倍。Glare等人利用qRT-PCR技术检测GAPDH在支气管肺泡灌洗回收液里的细胞和支气管内膜活检组织中的表达时,发现其在支气管患者组织的表达量低于正常人组织的表达量。因此,GAPDH在上述条件下作为内参基因遭到质疑。
3.2 β-actin
β-actin是肌动蛋白的一种,存在于所有真核细胞中且高度保守,因此常被作为内参基因广泛使用。Nygard等人应用荧光染料实时定量PCR方法研究不同基因在猪的不同组织表达水平的稳定性时,发现β-actin稳定表达。然而,在一些特定组织及试验条件下,β-actin表达量同样很不稳定。如Glare等人发现在哮*气道内β-actin表达不稳定;Bas等人利用qRT-PCR技术分析常用内参基因在人类T淋巴细胞中的表达稳定性试验中,研究结果也表明β-actin不适合作为内参基因。
3.3 18S rRNA和28S rRNA
rRNA即核糖体RNA,它由不同于mRNA合成的RNA聚合酶所合成,因此rRNA合成的调节独立于mRNA。通常在影响mRNA表达的条件下,各种rRNA水平很少发生变化,但是其表达易受到各种生物因素和药物的影响。在有丝分裂时期,18S rRNA和28S rRNA明显减少或停止表达,而且当对已纯化mRNA中的目标基因进行定量时,rRNA不能用于标准化;rRNA还高丰度表达,远远高于目标基因的表达量,且其不包括poly(A)尾,在以Oligo(dT)为引物的cDNA合成中不能被逆转录等缺陷。这些都是18S rRNA和28S rRNA作为内参基因的缺点。
正确选择内参基因,很大程度上依赖于所研究的细胞或组织及试验条件,不同的试验需要寻找适合试验体系的内参基因。常用的内参基因在某些细胞或组织及试验条件下虽然能够稳定表达,但在一些特定因素下表达量变化却很大。所以,使用qRT-PCR技术研究目的基因的表达情况时,需要根据样品类型及试验条件的不同,选择合适的内参基因作为标准。随着科技的进步,近年来出现了筛选稳定性好的内参基因的新方法,如使用GeNorm软件、基因芯片数据、EsT数据库。
4.1 基于软件选择内参基因
在qRT-PCR中,内参基因的稳定性非常重要,直接影响着试验结果的准确性。许多学者建议,在应用qRT-PCR技术进行表达分析时,可以选择多个内参基因作为校正标准。另外GeNorm、NormFinder和BestKeeper程序也可以用来比较内参基因表达的稳定性。GeNorm是由Vandesompele等人编写的专门用于qRT-PCR选择内参基因的程序,该程序可以计算出显示内参基因表达稳定性的M值,M值越大表明基因表达的稳定性越差,反之,基因表达的稳定性越好。NormFinder程序由Andersen等人编写,运行原理与GeNorm程序相似,但只能选出一个合适的内参基因作为标准。BestKeeper由Pfaffi等人针对内参基因和目标基因进行选择所编写的程序,其功能强大,不仅可以分析内参基因的稳定性,还可以比较目的基因的表达水平。
4.2基于基因芯片数据选择内参基因
随着人类基因组计划(HGP)的初步完成以及分子生物学科的迅猛发展,许多动植物以及微生物基因组被测定,目前基因序列数据仍在迅速增加。基因芯片(gene chip)技术是近年来发展起来的高通量、高效率的分子生物学技术,可以同时、快速、准确地分析数以千计基因组信息,并且可以自动、快速地检测出成千上万基因的表达情况。因此通过对基因芯片数据的分析可以发现在不同细胞类型和不同条件下稳定表达的基因作为候选内参基因。
4.3基于EST数据库选择内参基因
表达序列标签(expressed sequence tags,EST),又称表达序列标记,通常指来自表达基因片段3’端或5’端特异性代表一个基因部分信息的短脱氧核糖核酸序列,它可以代表生物体某种组织某一时间的一个表达基因。生物体内可以表达的基因序列只占整个基因组序列的极少部分,而EST所代表的cDNA序列正是反映这些表达基因的编码部分,所以根据EsT可以直接获得基因表达的信息。对cDNA文库公共数据库中的EST序列进行分类。寻找在特定cDNA文库中出现频率较高即表达丰度较高的EST序列,再结合网络搜索这些基因在不同试验条件下的表达谱,从而筛选出稳定性较好的候选内参基因。
以往的qRT-PCR试验通常只选择单一的内参基因作为校正标准,而近年的研究表明常用的内参基因,如GAPDH、β-actin、18S rRNA和28S rRNA在一些细胞组织和试验因素下表达都不太稳定。在试验过程中为了确保获得可靠的试验结果,研究者需根据自己的样本情况和试验条件,筛选出合适的内参基因作为目的基因的校正标准,保证试验结果的可靠性。
文章整理自“实时荧光定量PCR内参基因的选择”一文
