弱酸和弱碱的解离常数
强酸(盐酸、硫酸等)和强碱(氢氧化钠、氢氧化钾等)是在低浓度水溶液中完全电离的酸和碱。
在生物系统中,我们通常只遇到弱酸和弱碱。弱酸和弱碱在溶液中不会完全解离,而是未解离的和已解离的物质的平衡混合物。例如,在水溶液中,醋酸是醋酸根离子、氢离子和未解离的醋酸分子的平衡混合物。这些物质之间的平衡可以表示为:
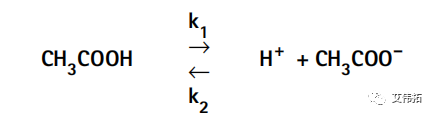
式中,k1为醋酸分子解离生成醋酸根离子和氢离子的速率常数,k2为醋酸根离子和氢离子结合生成醋酸分子的速率常数。醋酸的解离速率d[CH3COOH]/dt取决于解离速率常数(k1)和醋酸[CH3COOH]的浓度,可表示为:
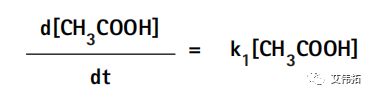
同样地,醋酸的生成速率d[HAc]/dt取决于结合速率常数(k2)以及醋酸根离子和氢离子的浓度,可表示为:
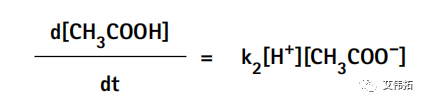
一般地,自上述反应开始起,弱电解质分子电离出离子的速率不断降低,而离子重新结合成弱电解质分子的速率不断升高,当两者的反应速率相等时,溶液便达到了电离平衡。此时,溶液中电解质分子的浓度与离子的浓度分别处于稳定状态,不再发生变化。
电离平衡可以简要概括为:在一定条件下,弱电解质的离子化速率等于其分子化速率。
由于在平衡条件下解离和再结合的速率相等,可得:
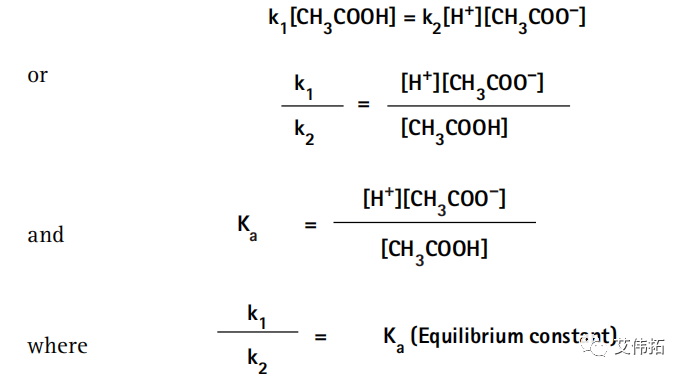
即溶液中的电离出来的各离子浓度乘积与溶液中未电离的电解质分子浓度的比值是一个常数,叫做该弱电解质的电离平衡常数,简称电离常数(Ka)。电离常数描述了一定温度下,弱电解质的电离能力。
而上面的平衡表达式可以重新排列为:
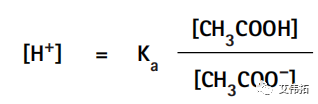
其中,氢离子浓度用平衡常数、醋酸分子以及醋酸根离子的浓度表示。
需要注意的是,电离平衡常数只适用于弱电解质的计算,强电解质不适用。并不是强电解质没有电离平衡常数,由于物理作用等因素影响,强电解质也并非完全电离。只不过强电解质不使用电离平衡常数进行相关计算。强电解质可以用阴阳离子平均活度来表示电离程度,参与计算。
