经常会有介绍说,NHEJ介导的DNA双链断裂修复引入的indel长度和序列是完全随机。但Megan van Overbeek和其同事研究该事件时,发现Cas9介导DNA双链断裂的修复结果并不是随机的。下面我们详细来看一看这篇2016年发表在molecular cell上,题为“DNA Repair Profiling Reveals Nonrandom Outcomes at Cas9-Mediated Breaks”的文章。
CRISPR/Cas9 KO原理
作为细菌或者古细菌的适应性免疫系统,CRISPR-Cas的免疫过程包括三步:第一步,将外源的基因组DN**段整合进入自身的CIRSPR阵列,这段DN**段对应外源基因组上序列被称为protospacer,对应CRISPR阵列上的序列被称spacer。第二步,CRISPR阵列被转录成RNA,即pre-CRISPR RNA,随后被加工成成熟的CRISPR RNA(crRNA)。第三步为干预阶段,crRNA通过互补配对识别外源入侵病毒基因组上的protospacer,并指导Cas蛋白切割降解该基因组。
而CRISPR/Cas9基因编辑技术就是是利用第三步的RNA介导靶向DNA的切割。Cas9切割基因组,产生DNA双链断裂(DSB)之后,细胞会启用DNA损伤修复机制来对DSB进行修复。当细胞选择同源重组介导的修复(HDR)时,修复后的DNA双链将与断裂前一致,即无错的修复方式。当细胞选择非同源末端连接(NHEJ)或者微同源末端介导的连接(MMEJ)时,将可能会产生小片段的插入或者缺失(indel),所以常规认为NHEJ或者MMEJ是一种易错的修复方式。在应对DSB时,细胞内最主要的修复方式是NHEJ(或者MMEJ),HDR仅占很小部分。且HDR修复后的双链DNA会继续被sgRNA识别,从而被Cas9切割。如果Cas9导致的DSB位点位于基因的CDS区,当NHEJ或者MMEJ引入的indel的长度是非3的倍数时,就会导致后续蛋白翻译移码,从而达到靶基因KO的目的。
将靶向基因组特定位置的sgRNA和Cas9共同转染293T/HCT116/K562细胞48h后,收集细胞的基因组DNA,PCR后进行二代测序,分析切割位置上下游50bp内碱基的插入和缺失情况(图1.A)。作者发现,在不同组的重复结果中,对于相同的sgRNA测序反馈的indel的类型和比例高度一致。相同的sgRNA,在不同的细胞中,占比最高的几类indel也高度一致,不过频率有差别。例如,相比于293T和K562细胞,HCT116展现出更高比例的一个腺嘌呤的插入,而缺失19bp片段的比例更低(图1.B),因此作者猜测,Cas9切割导致的DSB修复结果不是随机的。但具体是什么影响了修复结果?是sgRNA的序列(对应到基因组上为protospacer),还是protosapcer附近序列,即背景的影响呢?
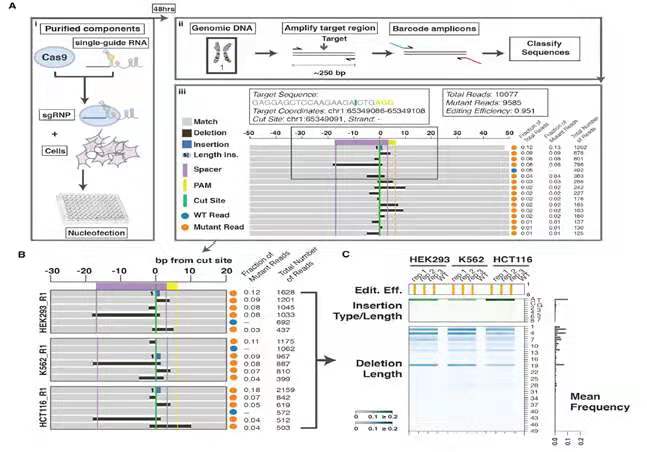
图1.分析Cas9切割DNA后修复检测流程及结果展示
为了回答这个问题,作者设计了一系列可以同时靶向人类基因组多个位置的sgRNA,总共有22个sgRNA,每个sgRNA在基因组上有2~14个靶点,共计127个靶点。
再次按照图1的流程进行实验分析后,作者发现,很多相同靶点虽然背景序列不同,但是其修复的结果高度一致(每个靶点三次独立重复实验)。以其中的第15号sgRNA的结果为例(图2),该sgRNA在基因组上有7个靶点,所有靶点的修复结果都非常相似,主要是单个腺嘌呤的插入和一个碱基的缺失。
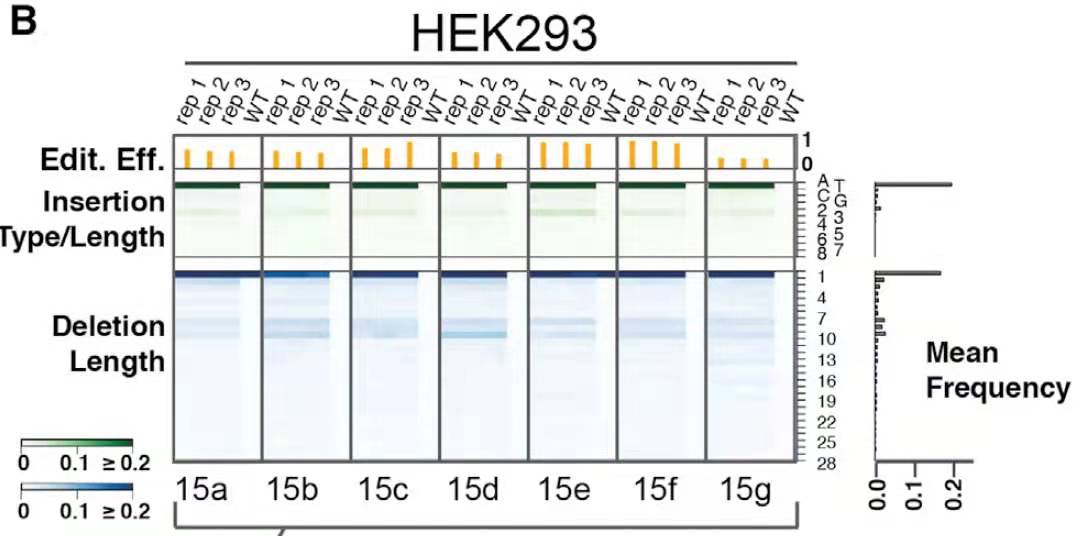
图2.第15号sgRNA介导Cas9切割靶点后修复结果展示
整体来看22个sgRNA,其修复结果在不同的基因背景下都非常接近(图3)。比如第6号sgRNA在基因组上有14个不同的靶点,第11号sgRNA在基因组上有10个不同的靶点,第22号sgrNA在基因组上有10个不同的靶点,其修复结果中不同类型(插入或者缺失,插入什么碱基,缺失什么位置多长片段)的比例都高度类似,说明Cas9切割产生的双链DNA断裂其修复结果是非随机且依赖protosapcer序列的(sgRNA靶向的序列),而与protospacer所在基因组上的背景序列无关。作者同时在K562中进行该验证,验证结果得出和293T细胞相同的实验结论。
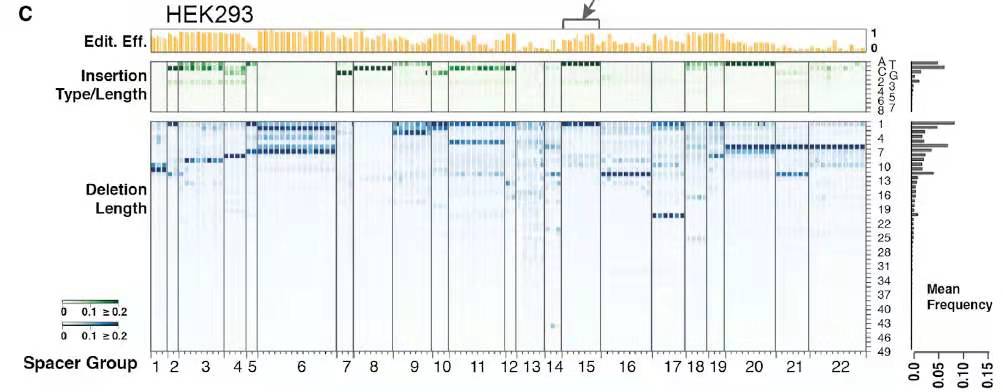
图3. 在293T细胞中,22个sgRNA靶点修复结果展示
DNA双链断链的主要修复同路包括NHEJ,MMEJ,SSA和HDR;由于SSA(单链退火)会导致大片段的缺失,HR是一种无错的修复方式,所以目前观察到的修复结果主要是NHEJ或者MMEJ导致。为了研究这两种修复方式对于修复结果的影响,作者对比了添加NU7441对于修复产物比例的影响。NU7441是一种DNA PKcs的抑制剂,可以抑制NHEJ修复通路。在添加NU7441后,观察到1bp的插入和1-3bp的缺失比例明显降低(图4),这说明在Cas9导致的DNA双链断裂的修复过程中,NHEJ主要参与1bp的插入和1-3bp的缺失,4bp以上的缺失主要是MMEJ修复通路导致的(微同源序列参与的,MH)。
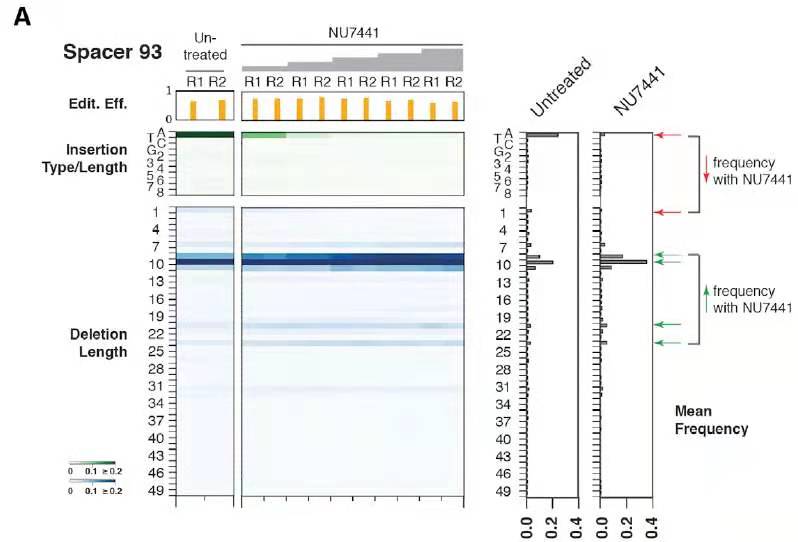
图4. 在细胞中添加DNA-PKcs抑制剂NU7441,抑制NHEJ后对比DNA修复结果变化
这篇文章向我们展示了一项非常有趣的研究结果,即Cas9导致的DNA双链断裂并不是被随机修复的,修复结果具有很强的靶点特异性。我们先看看这个结果给我们实验上的启示:如果认为DNA双链断裂修复过程是完全随机的,在确定靶点能够有效切割DNA后,使用混合克隆株直接验证wb的敲除效率一定会是有效的(2/3的移码概率);但是由于修复结果具有很强的靶点特异性,如果其中大部分是缺失3bp或6bp这类不产生移码的突变,那么此时即使有编辑基因组,蛋白水平很可能没有差异。另外,特定靶点对应特定的修复结果,暗示我们可以寻找合适的方法直接预测DNA修复结果,这样我们就可以直接设计特定sgRNA产生我们预期碱基的插入或者片段缺失,且相对于传统的KI,其相率将高出非常多。
欢迎大家持续关注吉凯基因公众号,后续我们将继续和大家分享文章是如何预测DNA双链断裂的修复结果。

吉凯基因拥有丰富的sgRNA设计经验,完善的病毒包装生产体系,严格的质控标准,为广大科研工作者提供可靠的基因调控产品。同时吉凯基因的CRISPR-Cas9系列产品已获得MIT及哈佛大学在**上的联合授权,欢迎大家咨询订购。
【参考文献】
Megan van Overbeek et al. DNA Repair Profiling Reveals Nonrandom Outcomes at Cas9-Mediated Breaks. Mol Cell. 2016 Aug 18;63(4):633-646.
