之前的软文有介绍过对于中枢神经系统的AAV靶向的相关课题思路研究,感兴趣的老师们可以进行相关的阅读。针对中枢神经系统而言,我们首先关注的是靶向的细胞类型。具体是神经元细胞还是胶质细胞,以及针对的是脑区还是脊髓,从而构建相对应的AAV方案。另外在针对不同脑区之间联系的研究上,有很多关于神经环路的研究。通常是通过对上游的神经元注射跨突触的AAV,进而对下游脑区进行检测,观察是否有相关荧光蛋白的表达。或者通过对下游的神经元注射retro的AAV病毒,去检测上游的神经投射情况。随着中枢和外周的研究越来越密切,关于中枢和外周之间的神经连接也是目前一个关注的热点。今天的这篇推文就根据文献,来给大家讲解一下关于外周和中枢之间联系的相关研究。
首先举例的这篇文章绘制了内脏-大脑特异性的连接,以及将大脑回路和内部器官功能联系起来的一系列研究。内脏和中枢神经系统之间存在着密切的联系,在中枢神经系统中,病灶神经回路的动态损伤晖导致器官的功能失调。利用神经传导病毒进行跨突触追踪,可以实现中枢神经系统内部器官的特异性投射的追踪。器官特异性感觉神经元会激活控制内脏功能的反射相关通路,并产生重要的感觉活动,包括痛觉、不适感等。进一步开发病毒追踪技术以了解大量内脏-大脑特异性回路,已成为未来治疗干预各种内脏功能障碍的当务之急。
文章首先对于内脏和大脑之间的联系做了相关的研究。孤束核(NTS)是目前公认的内脏-脑轴的枢纽核团。Han等人(2018年)[1]将一定体积的逆行带Cre的AAVrg-pmSyn1-EBFPCre注入到近端肠道、心脏、肺或者气管,而将Cre诱导的DIO-ChR2-EYFP 双侧注入结节神经节。图1绘制了NTS神经元的不同器官特异性的连接图。
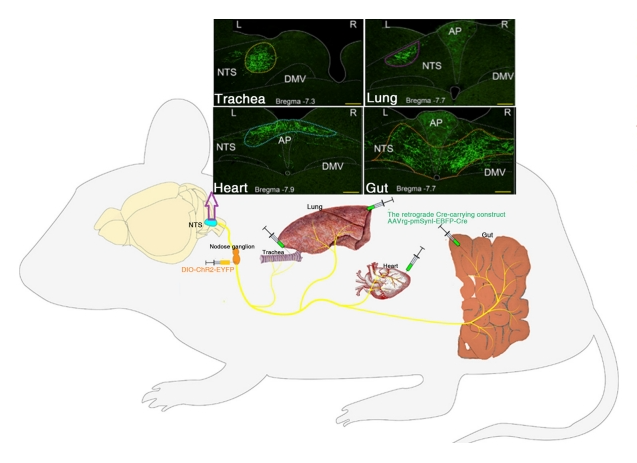
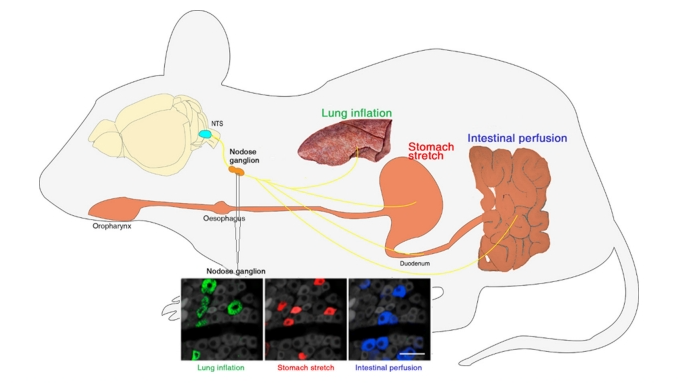
此外,迷走神经结是一个关键的中继结构,通过研究可以获得自律神经输入的外周信息。Williams 等人(2016 年)[2]开发了一种体内钙成像方法,该方法针对迷走神经节中的所有感觉神经元,使用 Cre 驱动系(Vglut2-ires-Cre)和 Cre 依赖性报告等位基因(lox-GCaMP3)。这些研究人员在进行了成像,并验证了结节神经节中存在内脏连接特异性神经元。图2还表明他们还报告了体内迷走神经节在各种内脏刺激下的单神经元反应,包括胃胀气、十二指肠营养施用、肠膨胀和肺充气时的单神经元反应。
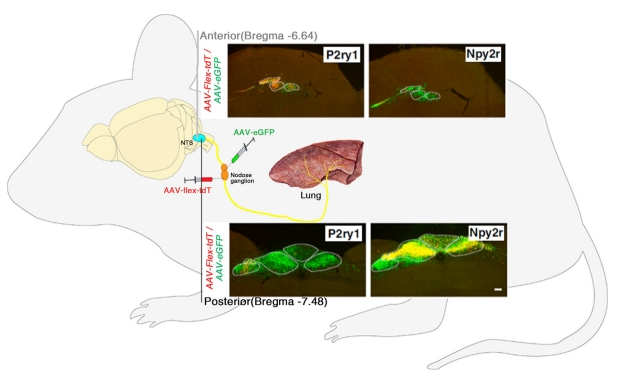
呼吸系统对中枢神经系统的神经输入对于正常的呼吸控制和呼吸过程至关重要。McGovern 等人(2012年)[3]用 HSV-1-H129 进行逆行神经元追踪,并结合免疫化学分析,揭示了与呼吸道相关的感觉回路。众所周知,慢速呼吸的控制是通过几个强大的中枢自律神经网络实现的。图3显示了肺迷走神经感觉结节与大脑的连接。Chang 等人(2015 年)[4]探索了不同呼吸状态的神经生理学,并提出了迷走神经感觉神经元亚型的分子多样性,这些亚型可以通过感知呼吸输入对呼吸进行不同的控制。小鼠迷走神经传入(P2ry1 和 Npy2r)密集地支配肺部,并向不同的大脑皮层发出长程投射。为了绘制这一图谱,研究人员向小鼠的结节/颈静脉神经节复合体感染了AAV-flex-tdTomato(AAV-flex-tdT)和AAV-eGFP,在P2ry1-iresCre和Npy2r-ires-Cre小鼠体内。图3显示了小鼠的脑干的冷冻切片。
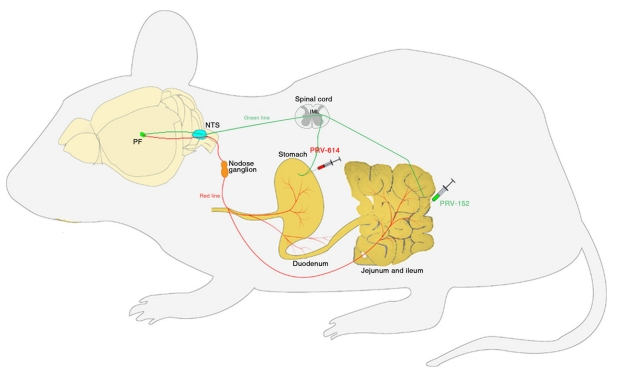
胃肠道受到中枢神经系统和外周神经系统的严格调控,以确保其正常运作。Rinaman 和 Schwartz(2004 年)[5]报告了胃相关感觉回路的跨神经元病毒追踪。他们将 HSV-1-H129 和 PRV 分别注射到大鼠腹侧胃壁或大鼠腹侧胃壁。在完整的大鼠中,HSV-1-H129感染出现在位于胸腔背角的神经元、髓质背角的神经元以及位于腹腔的神经元。在迷走神经切断的大鼠中,HSV-1-H129感染几乎只局限于左侧延髓背侧迷走神经复合体。目前,人们已充分认识到局部脑区与胃肠功能紊乱之间存在密切的对应关系。此外,图4还显示PRV 还被特异性地转运到DMV和 PF通过迷走神经通路。
通过对外周的一些病毒的注射,探究了中枢和外周之间相互联系的图谱。这篇文献的影响因子不高,主要是对之前的研究进行了一些相关的总结和展示,更多是方法上的论述,为中枢和外周之间的关系的研究起到了启示性的作用。
接下来可以学习一下,2023年11月1号,发表在Neture上的一篇名为“Vagal sensory neurons mediate the Bezold–Jarisch reflex and induce syncope”的文章的实验设计。这篇文献主要做的是经典Bezold–Jarisch(BJR)反射可能由迷走感觉神经元(VSN)介导,BJR表现为低血压、心动过缓和呼吸抑制,并导致动物晕倒,是一种心脏抑制反射。
首先作者为了评估心脏的神经支配,将AAV.PHP.S-DIO-Gcomet双侧注射到NPY2R-Cre小鼠的结节神经节去特异性标记感觉神经元而不是运动神经元(fig1a、1b)。VSN投射到脑干,结果表明在孤束核(NTS)以及核后区观察到密集的终端。为了克服结构上的障碍,使用了抑种全新的组织透明化的办法HYBRiD。结果表明和心房以及心弓相比,在心室壁中观察到更多数量的NPY2R-VSN纤维(fig1d)。为了探究VSN可以对其他的内脏器官也有神经支配,将具有不同荧光标记的retro-AAV通过心-肺和心-肠注射到NPY2R-Cre的小鼠(fig1e)。在结节中几乎没有观测到双标记,表明NPY2R VSN的不同子集对心脏、肺和肠道的投射有差异。AP主要接受来自心脏的VSN的神经支配,NTS由心脏、肺和肠道的VSN标记。神经纤维只观察到接收了retro-AAV的投射(fig1j)。这些结果都表明,VSN的器官存在一对一的映射,以及心脏投射到NPY2R VSN主要靶向心室壁以及决定AP神经支配。
之后通过在AP放置一个光纤在ChR2小鼠来刺激心室末端。不仅能够探究心室VSN在心血管生理上的作用,还可以检测对清醒自由活动动物行为的影响(vNAS)。在vNAS的几秒内,小鼠自发摔倒并无法动弹(fig1l)。为了记录在vNAS期间自由活动的小鼠的脑电图(fig1k),并通过在vNAS旁边记录脑电图(EEG)来开发一种无偏见的电生理标志物。结果表明脑电波在8-100HZ突然下降(fig1m)。在昏厥患者的脑电图也观察到大脑震荡的减少。因此,数据表明VNAS会诱发晕厥。
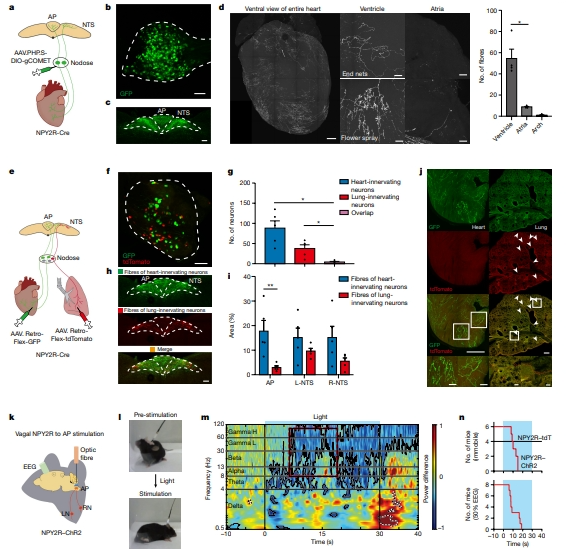
通过这样的方式,作者证明了迷走神经对于中枢神经系统的调控。注射逆行示踪病毒的思路值得我们在外周和中枢的关系的相关研究中进行借鉴。如果老师们对于这篇文献感兴趣也可以点击进行阅读。
那么对于中枢和外周之间相互关系的研究就介绍到这里,如果各位老师对于文献中所使用的相关病毒感兴趣的话也欢迎向我们进行咨询~
参考文献…
[1].Han, W., Tellez, L.A., Perkins, M.H., Perez, I.O., Qu, T., Ferreira, J., Ferreira, T.L., Quinn,
D., Liu, Z.W., Gao, X.B., Kaelberer, M.M., Bohorquez, D.V., Shammah-Lagnado, S.J.,
de Lartigue, G., de Araujo, I.E., 2018. A neural circuit for gut-induced reward. Cell
175, 665–678 e23.
[2]. Williams, E.K., Chang, R.B., Strochlic, D.E., Umans, B.D., Lowell, B.B., Liberles, S.D.,
2016. Sensory neurons that detect stretch and nutrients in the digestive system. Cell
166, 209–221.
[3]. McGovern, A.E., Davis-Poynter, N., Farrell, M.J., Mazzone, S.B., 2012. Transneuronal
tracing of airways-related sensory circuitry using herpes simplex virus 1, strain H129.
Neuroscience 207, 148–166.
[4]. Chang, R.B., Strochlic, D.E., Williams, E.K., Umans, B.D., Liberles, S.D., 2015. Vagal
sensory neuron subtypes that differentially control breathing. Cell 161, 622–633.
[5]. Rinaman, L., Schwartz, G., 2004. Anterograde transneuronal viral tracing of central viscerosensory pathways in rats. J. Neurosci. 24, 2782–2786.
[6]. Lovelace, J.W., et al., Vagal sensory neurons mediate the Bezold–Jarisch reflex and induce syncope. Nature, 2023. 623(7986): p. 387-396.
