CAR-T疗法就是嵌合抗原受体T细胞免疫疗法,英文全称Chimeric Antigen Receptor T-Cell Immunotherapy。这是一种治疗肿瘤的新型精准靶向疗法,近几年通过优化改良在临床肿瘤治疗上取得很好的效果,是一种非常有前景的,能够精准、快速、高效,且有可能治愈癌症的新型肿瘤免疫治疗方法。这种免疫治疗方法发展迅速,食品药品监督管理局(FDA)已经批准的CAR-T细胞用于治疗淋巴瘤和白血病。
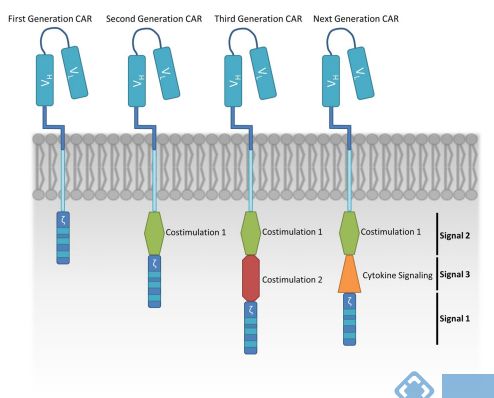
T细胞激活需要多个信号才能实现完整和最佳的效应子功能。这些包括TCR参与(Signal 1),共刺激因子(Signal 2)和细胞因子感测(Signal 3)。CARs旨在模仿TCR复合体的功能,并逐步进化以整合其他信号。正在进行的研究工作集中于将CAR-T细胞用作其他癌症的疗法,并通过优化其设计来提高功效和安全性。
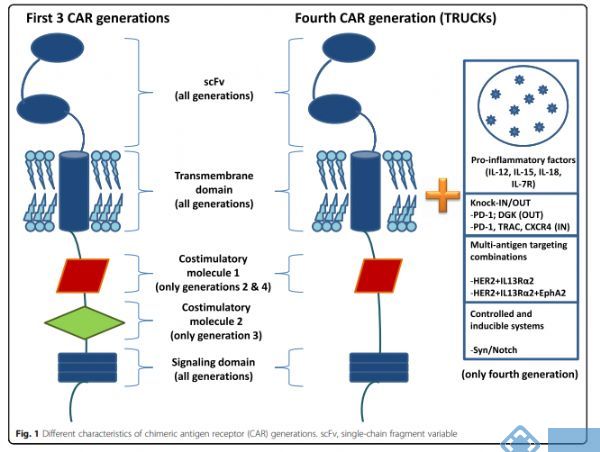
CAR结构设计可分为3个部分:1)涉及抗原识别的细胞外结构域。该区域由(特异性)识别肿瘤相关抗原(TAA)的scFv组成,scFV是固定在T细胞上通过2)跨膜结构域,其由CD3,CD8,CD28或FcεRI的跨膜区域组成。该区域连接到3)细胞内区域,该区域由CD8,CD28或CD137和CD3ζ的胞质区域组成。在这里,尝试总结下目前第一代,第二代,第三代以及第四代CAR-T疗法载体设计中针对胞内域的修改或者优化。
第一代CARs:抗原结合结构域直接与TCR恒定链CD3ζ的细胞内部分融合。第一代CAR通过CD3ζ中基于免疫受体酪氨酸的激活基序(ITAM)域的磷酸化来启动激活级联反应。但是该信号不足以激活静止的T细胞。因此,最初的临床试验结果令人失望。
第二代CARs:为了克服第一代CARs的问题,将来自其他受体例如CD28、4-1BB(CD137)的共刺激域融合到CAR的细胞内片段,以改善T细胞的激活,增殖和存活。这一设计策略在一项出色的临床研究中得到了证明,淋巴瘤患者接受了针对相同抗原的第一代和第二代CAR-T细胞的混合物输入。通过对输注后样品的持久性进行分析,作者发现CD28的加入与第一代相比,对CD19 CAR-T细胞的共刺激增加了细胞的扩增和存活。总体而言,CD28共刺激可提供强大的细胞活化和扩增反应,但这似乎是以降低CAR-T细胞长期持久性为代价的。而4-1BB(CD137)能够改善CAR-T细胞的长期持久性,促进CD8+T细胞的记忆。在此基础上,第三代CARs就出现了。
第三代CARs:在第二代的基础上增加了其他信号域,并有望增强T细胞的活化,增殖和存活。将CD28和4-1BB(CD137)作为第三代的共刺激分子,相比第二代具有更大的体内扩增能力和更长的持久性。文章In Vivo Fate and Activity of Second- versus Third-Generation
CD19-Specific CAR-T Cells in B Cell Non-Hodgkin's Lymphomas就很好的说明了这点。但也有一些研究表明第二代CAR-T细胞的性能优于第三代CAR-T细胞。结果表明,包含CD28作为共刺激对PSCA有特异性的第二代CAR-T细胞在实体肿瘤模型中比包含CD28和4-1BB作为共刺激的第三代CAR诱导了更有效的抗肿瘤免疫应答。此结论在A novel chimeric antigen receptor against prostate stem cell antigen
mediates tumor destruction in a humanized mouse model of pancreatic cancer(Hum Gene Ther. 2014 Dec;25(12):1003-12. doi: 10.1089/hum.2013.209)文章中有体现。这些文章都强调需要更深入地了解调节CAR功能的结构与功能之间的关系。这一知识将有助于CAR输出信号的微调,以实现最有效的抗肿瘤反应。
第四代CARs:引入一个细胞内结构域,该结构域能够触发原本由细胞因子诱导的信号(Signal 3)进一步增强T细胞应答。第四代,也称为TRUCK,即T cells redirected for universal
cytokinemediated killing,既具有共刺激因子又具有促炎因子,例如白介素IL-12,
从而提高T细胞功效。第四代CAR不仅限于IL-12,已开发出不同类型的分子用于构建TRUCK。这些细胞因子包括IL-15(类似于IL-12,这种白介素可增强T记忆干细胞的发育)、IL-18,以及组成性活跃的细胞因子受体,例如IL-7受体(C7R),其目的是克服细胞因子毒性的风险。TRUCKs的其他一些测试包括敲除基因(PD-1或DGK)和敲入基因(TRAC或CXCR4),其目的是改善CAR表达和抗肿瘤活性。
考虑到最终控制抗肿瘤功效的变量众多,似乎每种肿瘤类型,胞外域和/或靶抗原的每种特异性共刺激信号的贡献可能是不同的。因此为了解决这些系统的复杂性,并为合理设计下一代CAR-T细胞的合理设计准则,将需要对CAR方面的共刺激分子免疫生物学进行系统的重新评估。下一代CAR-T细胞产品应整合新功能,以解决目前该技术治疗的肿瘤类型少的问题,副作用大,治疗费用昂贵,制备时间长等问题。但是无论采用哪种方法,都需要对CAR信号以及T细胞,肿瘤细胞及其环境之间的相互作用有更详细的了解,以定制CAR-T细胞的设计以获得最佳治疗效果。