随着现代生活质量的提高,肥胖已成为现在较为严重的公共健康问题之一,肥胖与II型糖尿病、心脑血管疾病以及其他疾病的发生密切相关[1]。了解肥胖与疾病的发生和发展背后相关的机制对于疾病的治疗至关重要。
在下丘脑室旁核区(paraventricular nucleus , PVN),有一类神经元专门负责监控外周代谢状态,并通过调节自主神经系统调控食物摄入和身体代谢[2,3]。星形胶质细胞是脑内重要的胶质细胞,在生理和病理条件下,星形胶质细胞参与维持神经元的正常功能,并参与调控神经网络的可塑性[4]。下丘脑星形胶质细胞也一直被认为在机体能量代谢中担当重要角色,但PVN区星形胶质细胞具体如何控制机体能量代谢尚不清楚。
最近,巴黎大学Serge H. Luquet研究团队在Cell Metabolism上 发表了题为 Hypothalamic astrocytes control systemic glucose metabolism and energy balance的工作,发现了PVN中星形胶质细胞通过与神经元互作参与调控葡萄糖代谢和能量平衡的机制,拓展了星形胶质细胞胶质细胞在代谢调控中的作用[5]。
由于PVN神经元在调控代谢中的重要作用[6],研究者们首先通过化学遗传学的方式操纵PVN 星形胶质细胞的活性观察小鼠代谢反应。研究者们向Aldh1l1-Cre小鼠的PVN区分别注射AAV5-EF1a-DIO-mCherry或AAV5-EF1a-DIO-hM3Dq-mCherry病毒(图1A)。在给予CNO激活PVN星形胶质细胞后,结果显示小鼠机体对葡萄糖代谢能力降低(图1B),血浆中胰岛素水平增加(图1C),相应的胰岛素原指数也明显增加(图1D)。除此之外,研究者们还发现给予CNO激活PVN星形胶质细胞后小鼠核心体温会升高(图2I)。这些结果说明PVN星形胶质细胞对葡萄糖代谢、产热起调控作用。

图1:化学遗传学激活PVN星形胶质细胞引起葡萄糖代谢和胰岛素释放异常

图2: 化学遗传学激活PVN星形胶质细胞引起小鼠体温增加
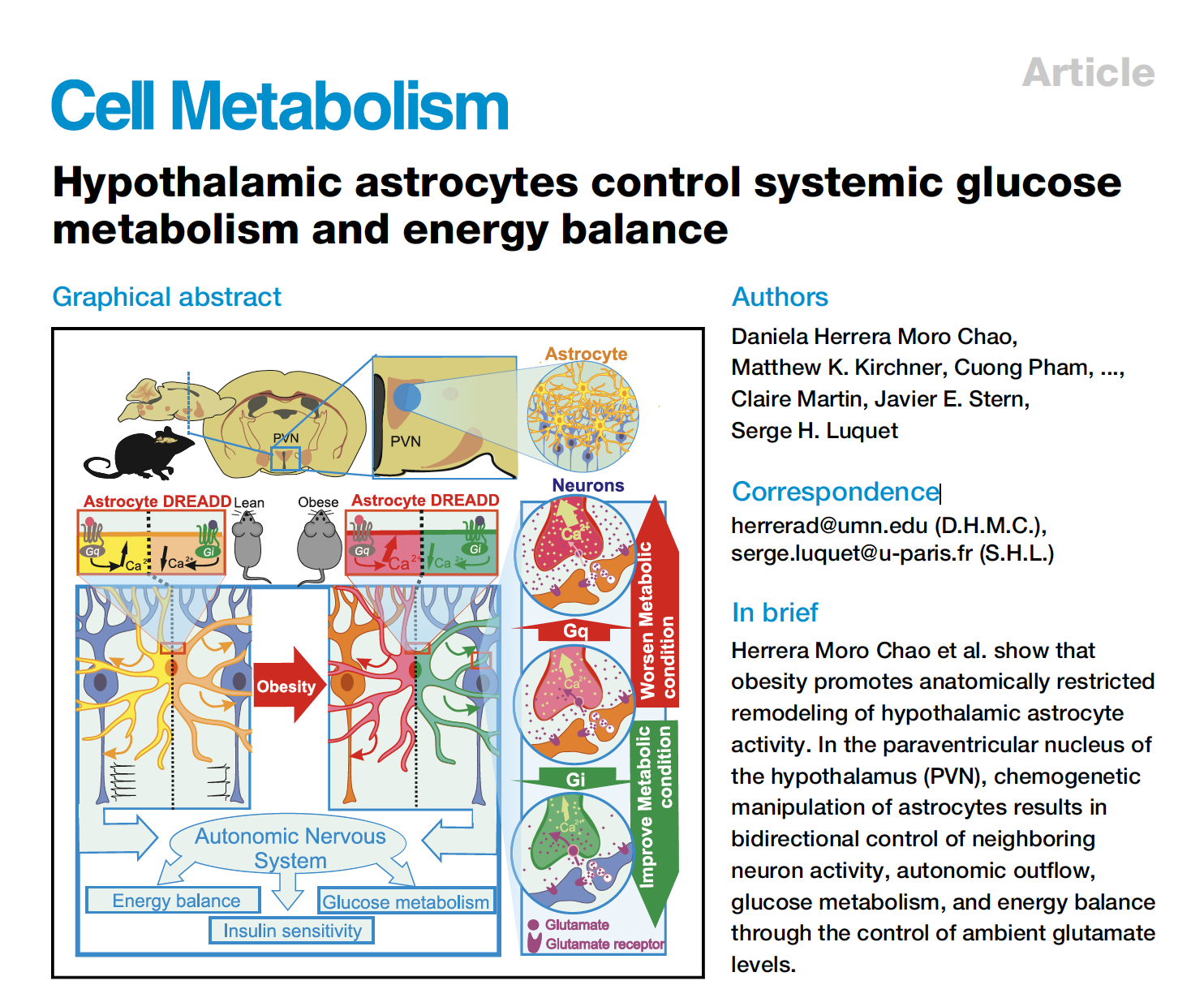
在探究完PVN星形胶质细胞在正常小鼠葡萄糖代谢及体温调控方面的作用后,研究者们想弄清楚PVN星形胶质细胞在肥胖小鼠中起的作用。同样,研究者们通过向C57BL/6J小鼠PVN区分别注射AAV5-EF1a-DIO-mCherry或AAV5-EF1a-DIO-hM3Dq -mCherry病毒 并加以CNO从而通过化学遗传学手段操纵星形胶质细胞的活动。结果发现通过CNO处理激活PVN星形胶质细胞活性会引起肥胖模型(C57Bl6j:PVNhM3Dq)小鼠胰岛素释放显著增加(图3C),但并没有引起肥胖小鼠的食物摄入变化(图3F),只引起了黑暗期小鼠能量消耗减少(图3G)。这些结果表明CNO激活PVN星形胶质细胞会促进系统性葡萄糖代谢紊乱,从而可能加剧肥胖小鼠能量储存代谢综合征。
PVN星形胶质细胞调控机体代谢背后的分子机制又是怎样的呢?由于之前的研究表明PVN中的小细胞前自主神经元会向脑干和脊髓中的自主中枢形成投射,进而控制必要的适应性代谢响应,从而实现适当的系统性葡萄糖代谢和能量平衡调节[7]。所以研究者们将目光放到了小细胞前自主神经元与星形胶质细胞的交互作用,并记录了星形胶质细胞与小细胞的电活动。结果显示在正常小鼠中,CNO激活星形胶质细胞会引起神经元放电频率显著增加(图4B、C),但在肥胖小鼠中并没有观察到类似的现象。
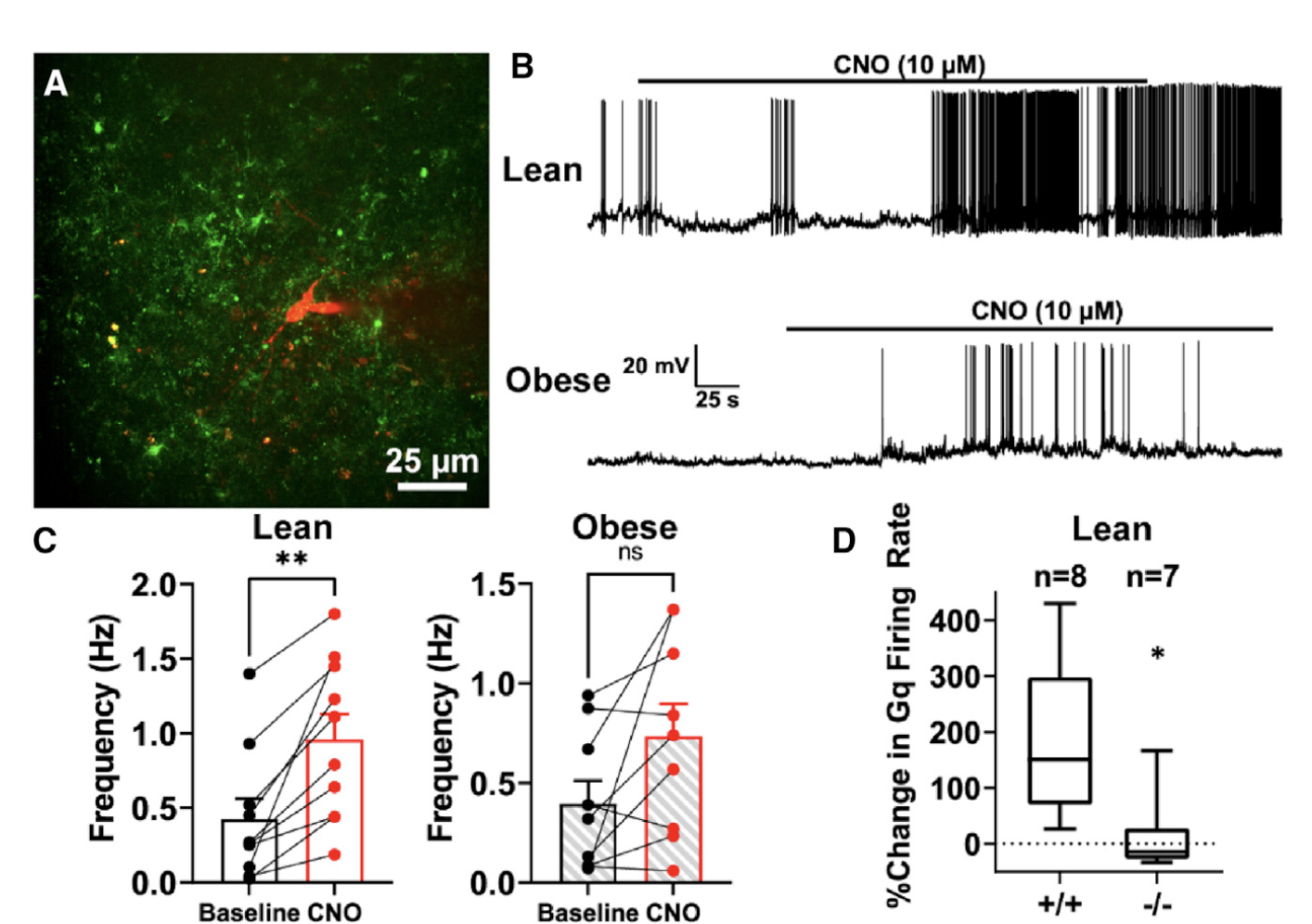
图4:激活PVN星形胶质细胞引起瘦小鼠微小细胞电发放频率增加,对肥胖小鼠微小细胞电发放频率无显著影响
谷氨酸作为神经元和胶质细胞相互作用的关键信号分子,其是否是PVN星形胶质细胞调控小细胞神经元兴奋性的关键分子呢?因此研究者们通过KYN阻断了谷氨酸信号传递,并对正常和肥胖小鼠小细胞神经元的电活动进行了观察,结果显示KYN可以明显阻断正常小鼠和肥胖小鼠神经元活性的增加(图5H、I)。这些结果表明PVN星形胶质细胞对小细胞神经元电活动起控制作用,并且这个过程是谷氨酸依赖的,而肥胖小鼠中谷氨酸含量异常可能是星形胶质细胞对小细胞神经元调控异常的关键因素。

图5:阻断谷氨酸信号可同时阻断PVN星形胶质细胞对小细胞神经元的调控
总之,这项工作发现肥胖会引起PVN星形胶质细胞活性的变化,在非肥胖小鼠PVN区通过化学遗传学操纵星形胶质细胞可以引起邻近区域小细胞神经元电活动增加,进而实现对葡萄糖代谢、能量平衡、体温等的调控,这些则依赖于星形胶质细胞—小细胞神经元之间的谷氨酸信号实现。这些发现也突出了星形胶质细胞在机体代谢中的关键作用,并提出了反肥胖策略的潜在目标。

公众号底部菜单栏【新功能】上线!
病毒实验帮
免费在线学习《国自然热点研究》、《数据库及软件操作教程》
一键下载《病毒使用手册》、《高分文献》
还有不定时的送新书、抽奖活动,赶紧来扫码关注一波吧
参考文献…
[1] Morton, G.J., Meek, T.H., and Schwartz, M.W. (2014). Neurobiology of food intake in health and disease. Nat. Rev. Neurosci. 15, 367–378.
[2] Dietrich, M.O., and Horvath, T.L. (2013). Hypothalamic control of energy balance: insights into the role of synaptic plasticity. Trends Neurosci. 36, 65–73.
[3] Licht, C.M., de Geus, E.J., and Penninx, B.W. (2013). Dysregulation of the autonomic nervous system predicts the development of the metabolic syndrome. J. Clin. Endocrinol. Metab. 98, 2484–2493.
[4] Verkhratsky, A., and Nedergaard, M. (2018). Physiology of Astroglia. Physiol. Rev. 98, 239–389.
[5] Herrera Moro Chao et al. (2022),. Hypothalamic astrocytes control systemic glucose
metabolism and energy balance. Cell Metabolism 34, 1532–1547.
[6] Li, C., Navarrete, J., Liang-Guallpa, J., Lu, C., Funderburk, S.C., Chang, R.B., Liberles, S.D., Olson, D.P., and Krashes, M.J. (2019). Defined paraventricular hypothalamic populations exhibit differential responses to food contingent on caloric state. Cell Metab. 29, 681–694.e5.
[7] Durkee, C.A., and Araque, A. (2019). Diversity and specificity of astrocyte neuron
communication. Neuroscience 396, 73–78.
