RNA的N6-甲基腺苷(N6-methyladenosine,m6A)修饰通过影响mRNA稳定性、翻译、转位调控RNA代谢,进而调控多种生物通路。近年来m6A被认为是宿主免疫细胞区分自身和非自身的重要机制,也可能是病毒免疫逃避的一种机制,然而m6A在先天免疫中的作用尚不清楚。
2019年4月23日,中国医学科学院北京协和医学院在《Nature Communications》(IF:12.353)上发表了题为“Mettl3-mediated mRNA m6A methylation promotes dendritic cell activation” 的文章,揭示了RNA甲基化转移酶Mettl3介导的m6A修饰促进树突状细胞(DC)功能活化的分子机制。

研究方法
首先,作者利用DC模型检测m6A修饰在DC成熟过程中的表达情况,发现成熟DC(maDC)中m6A修饰水平及其甲基转移酶水平显著升高(图1.a b)。随后在转录组水平,作者利用免疫沉淀联合高通量测序技术(meRIP-seq)分析m6A修饰,富集到高置信度的m6A峰,GO富集分析发现这些转录本聚类在免疫系统和炎症反应中(图1.e)。
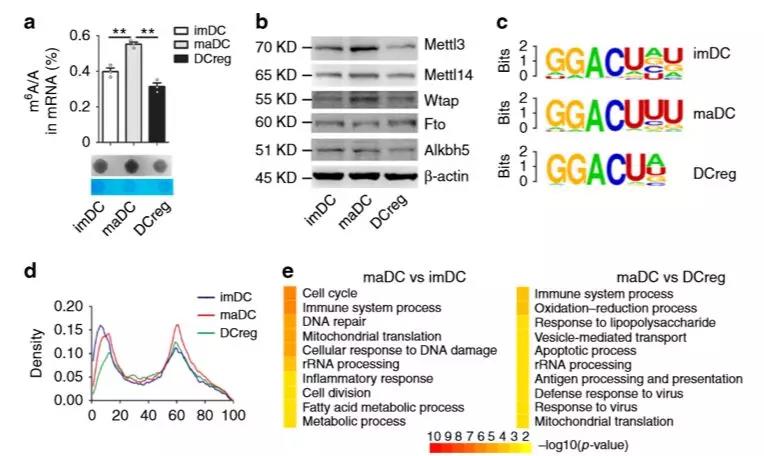
图1. m6A修饰水平在maDC中升高
接着,作者在DC中特异性缺失Mettl3基因(Mettl3KO),研究m6A在DC成熟和功能中的作用,发现Mettl3基因缺失,共刺激分子表达下降,促炎细胞因子的产生受损(图2.a-d)。
使用吉凯基因提供的慢病毒产品Lenti-Mettl3(M3-Wt)和Lenti-Mettl3分别过表达野生型Mettl3(M3_Wt)和突变型Mettl3,过表达M3_Wt可恢复正常功能,过表达突变型没有这种效果(图2.f、g),表明Mettl3介导的m6A修饰促进DC的成熟和促炎细胞因子的分泌。
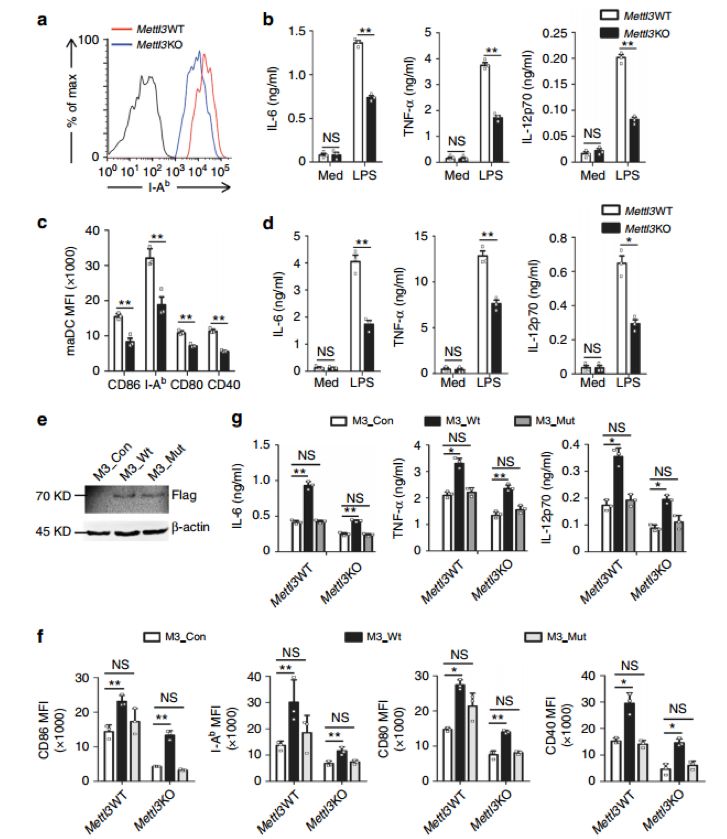
图2. Mettl3以催化m6A的方式促进DC成熟
此外,作者还检测了Mettl3 KO的DC促进T细胞增殖的情况,通过体外和体内实验发现Mettl3的m6A催化活性是DC促进T细胞增殖功能必需的(图3)。
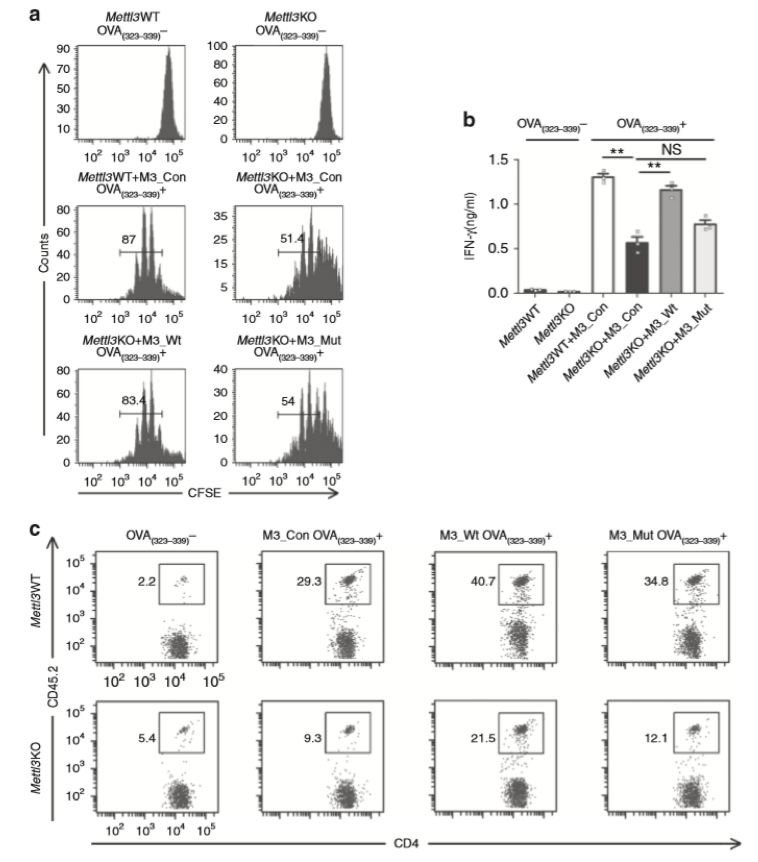
图3. Mettl3催化m6A的方式促进DC催化T细胞增殖
作者进一步研究了Mettl3介导m6A促进DC成熟和活化的分子机制。RNA-seq发现Mettl3缺失导致TLR4/NF-κB通路下游的分子表达下调(图4.a、b),测量该通路分子的表达和磷酸化水平,发现分子的表达和磷酸化水平显著降低(图4.e),表明基因的下调可能由转录活性降低导致。
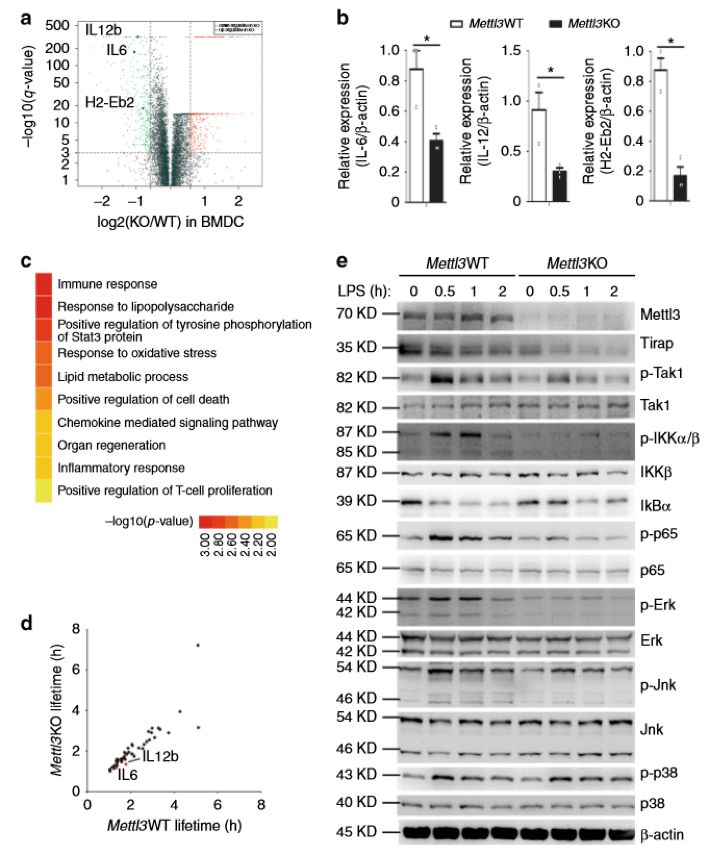
图4. Mettl3在DC成熟过程中增强先天反应和NF-κB通路信号传导
然后作者探究了Mettl3是否是通过m6A依赖机制调控Tirap、CD80、CD40的表达。发现Mettl3KO maDC中CD40和CD80在蛋白水平、m6A修饰水平降低(图5.a-c)。基因组核糖体分析发现,Mettl3KO maDC中蛋白的翻译效率降低(图5.d、c)。
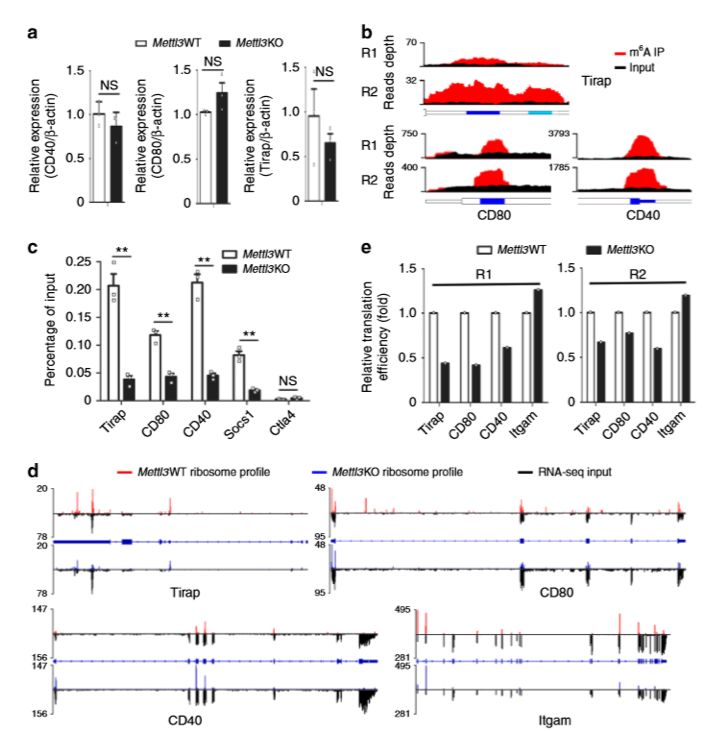
图5. Mettl3在体内促进Tirap、CD80和CD40 mRNA的翻译
同时,体外实验也得到类似的结果(图6),表明Mettl3介导的m6A修饰促进了Tirap、CD40、CD80的翻译表达。
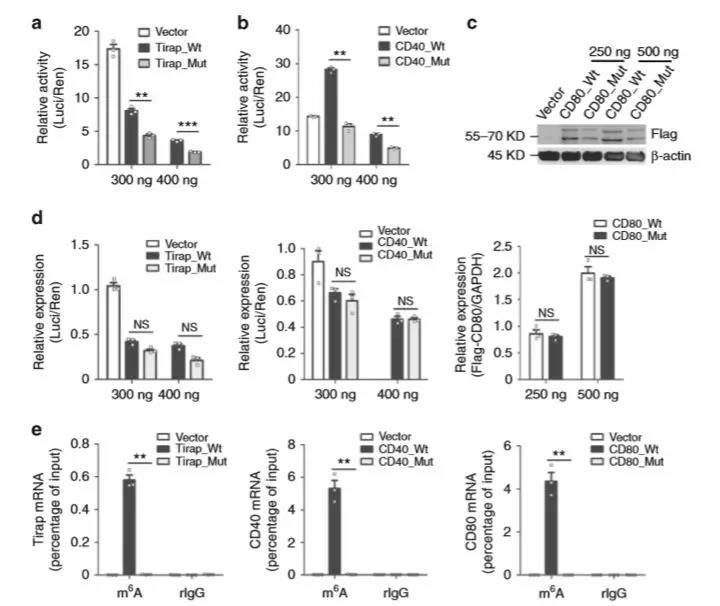
图6. Mettl3在体外促进Tirap、CD80和CD40 mRNA的翻译
最后,作者使用免疫沉淀反应和基因敲除实验研究了m6A阅读器Ythdf1与CD40和CD80翻译增加的关系,发现Ythdf1可以识别m6A修饰的mRNA,促进CD40和CD80 mRNA翻译(图7)。

图7. CD40和CD80的m6A依赖性翻译增强与Ythdf1呈正相关
总 结
1. Mettl3介导的CD40、CD80和Tirap的m6A在促进DC活化和成熟中起重要作用;
2. CD40和CD80的上调表达有助于DC的抗原呈递和T细胞刺激;
3. Tirap的高表达增强了TLR4/NF-κB信号,提高了促炎细胞因子的分泌。
吉凯助力
该研究中慢病毒产品:Lenti-Mettl3、Lenti-Mettl3及对照病毒均由吉凯基因提供。通过感染树突细胞(DCs),使其有效的过表达野生型或突变型Mettl3,进而帮助证明了Mettl3通过催化m6A修饰促进DC的成熟和促炎细胞因子的。
建有国内大型的慢病毒文库,包含几乎覆盖人类所有基因的,近 15 万个独立克隆;
国内集产品采购和资讯分享的一体化综合服务平台,为科研工作者提供一键式的采购服务,产品周期短至 5 个工作日起;
18年品质保证、助力客户发表10000+ 篇 SCI,多项科研成果发表于Nature Medicine、Nature Immunology、Gastroenterology、Cell Metabolism、Nature Neuroscience等顶级期刊上
