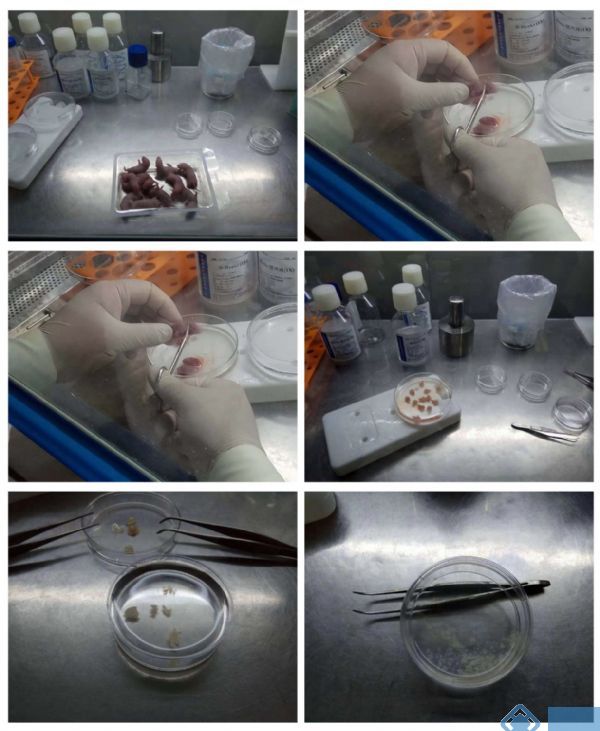
一. 实验方法
1. 多聚赖氨酸(Poly-D-Lysine)包被培养板的制备:原代分离进行前一天,用PBS缓冲液配制终浓度为0.1mg/ml的多聚赖氨酸工作液,0.22μm滤膜过滤除菌,于超净工作台内吸取1ml加入六孔板内,确保覆盖板底,静置孵育30min后吸出(可回收反复使用2-3次),用无菌水清洗培养板,置于超净台内晾干,照紫外过夜。
2. 次日,取出生24h以内的SD大鼠,75%乙醇浸泡消毒5min。
3. 棉球吸干乳鼠体表的乙醇,迅速断头,浸泡于冰冷的含有2%双抗的PBS缓冲液中。
4. 剪开颅骨,取出脑,转移至新的培养皿中,逐个剥离大脑皮层并浸泡于冰冷的含有2%双抗的D-HANKS液中。
5. 将剥离的皮层清洗两遍,弃去液体,用眼科剪迅速将皮层剪碎至糜状。
6. 加入2倍体积的木瓜酶(使用前用PBS稀释至终浓度2mg/ml),放入37℃培养箱内消化20min,期间用移液管吹打1-2次使之分散。
7. 消化结束后,加入10倍体积的D-HANKS液,同时加入1mg/ml的DNA酶,吹打混匀。
8. 用100μm孔径的细胞筛过滤悬液一次,移至新的15ml离心管内,1000rpm离心5min。
9. 弃去上清,D-HANKS液重悬细胞,吹打使之分散,并用70μm细胞筛过滤一遍,转移至新的离心管,再次1000rpm离心5min。
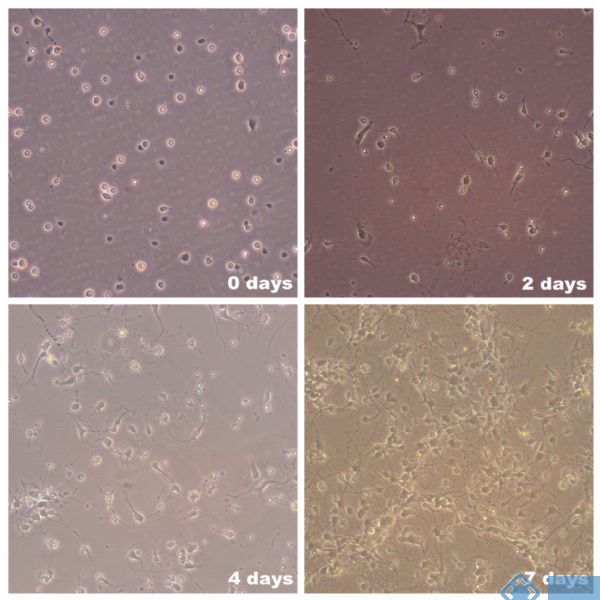
10. 弃去上清,用含有1%GLUT-MAX和2% B-27的Neurobasl-A培养基重悬细胞,调整浓度为3×105/ml铺于多聚赖氨酸包被的六孔板中,37℃ 5%CO2培养箱内培养。
11. 4h后换液,弃去培养基和未贴壁细胞,并用PBS轻轻冲洗一遍,加入新鲜的含有1%GLUT-MAX和2% B-27的Neurobasl-A培养基继续培养,后续没3天换液。
12. 一周后神经元完全展开,可用于后续试验。
二. 结果与分析
1. 取材&分离
2. 细胞培养