自然界中个体生物会采取各种防御性行为来抵挡天敌以及环境中各种危险因素。正常的防御性行为对于生物的生存至关重要,然而病理情况下的防御行为会导致个体产生过度焦虑。病理性的防御行为主要由于恐惧记忆的泛化,即恐惧记忆随着时间流逝其背景特异性逐渐减弱。背景关联型恐惧记忆的泛化是创伤后应激障碍的核心症状。那么介导恐惧泛化的神经环路机制究竟是怎样呢?
2019年神经科学顶级杂志《The Journal of Neuroscience》(最新IF:6.074)以长文(Original Article)形式正式发表了南京医科大学药学院朱东亚教授团队的研究成果‘Anterior Cingulate Cortex to Ventral Hippocampus Circuit Mediates Contextual Fear Generalization’。研究发现:前扣带皮层(anterior cingulate cortex, ACC)至腹侧海马(ventral hippocampus, vHPC)的神经环路是介导背景关联型恐惧记忆泛化的关键神经环路。

前额皮层和腹侧海马在恐惧记忆的研究中已很常见,这两个脑区在恐惧记忆的获得、巩固以及提取过程中均发挥着非常重要的作用。然而它们之间的神经投射关系以及在背景关联型恐惧记忆泛化过程中起着怎样的作用还不明确。
朱东亚教授课题组聚焦背景关联型恐惧记忆泛化的神经环路机制,从背景关联型恐惧记忆激活的脑区出发,研究前扣带回和腹侧海马之间的投射关系,并证明了前扣带回至腹侧海马神经投射的过度激活导致了背景关联型恐惧记忆的泛化,且通过光遗传学或化学遗传学技术手段特异性抑制该神经环路能够显著减少恐惧记忆的泛化。
研究方法与结果
1. 前扣带回和腹侧海马参与恐惧记忆泛化:首先实验通过小鼠背景关联型恐惧记忆模型确证了恐惧记忆的远期泛化现象。接着通过即早基因c-fos的免疫组织化学标记实验证实了前扣带皮层ACC和腹侧海马vHPC参与了恐惧记忆的远期泛化。
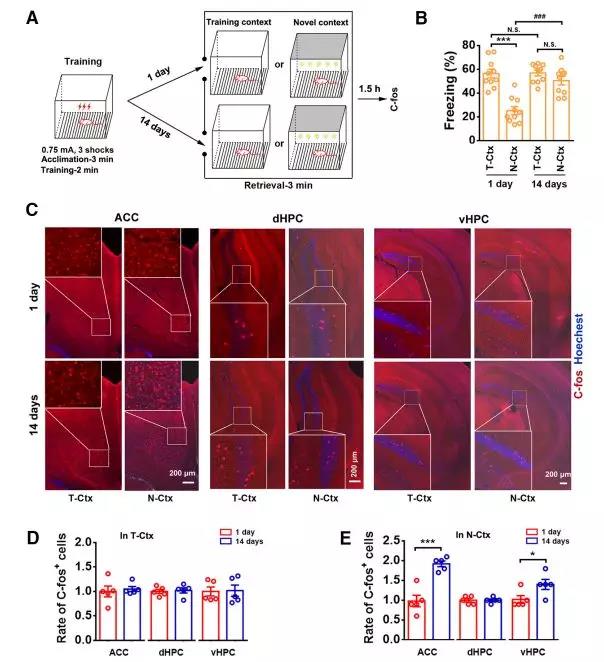
图1.前扣带回和腹侧海马参与恐惧记忆泛化
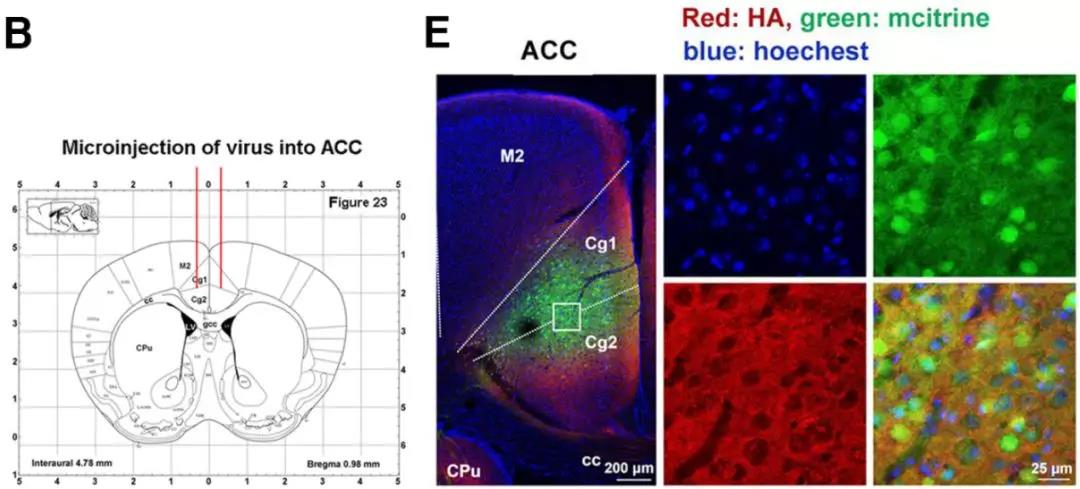
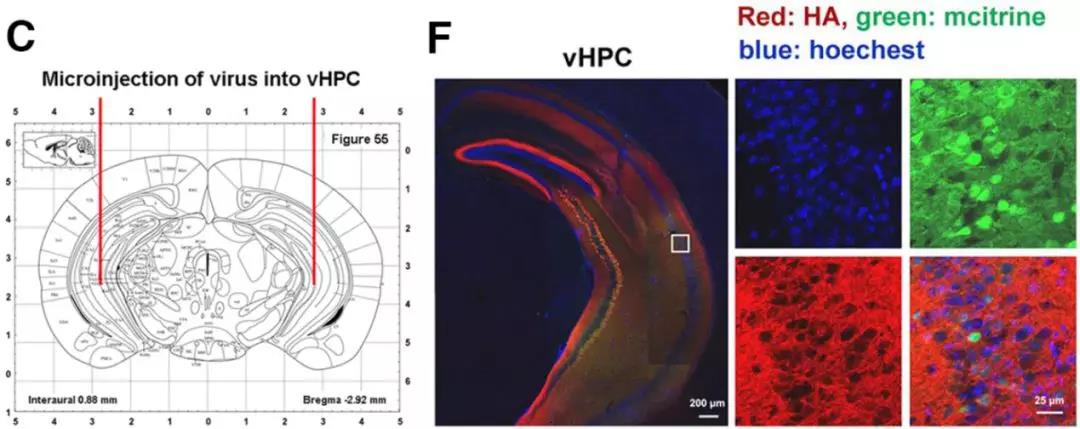
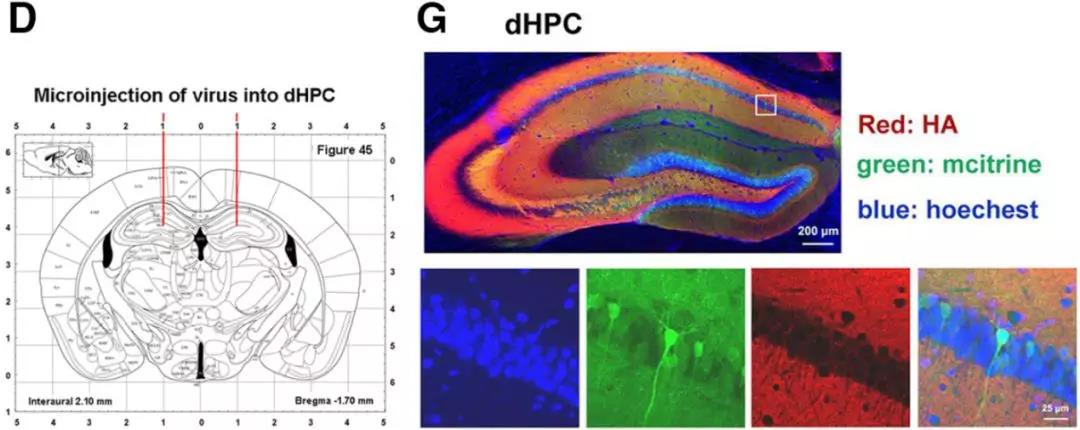
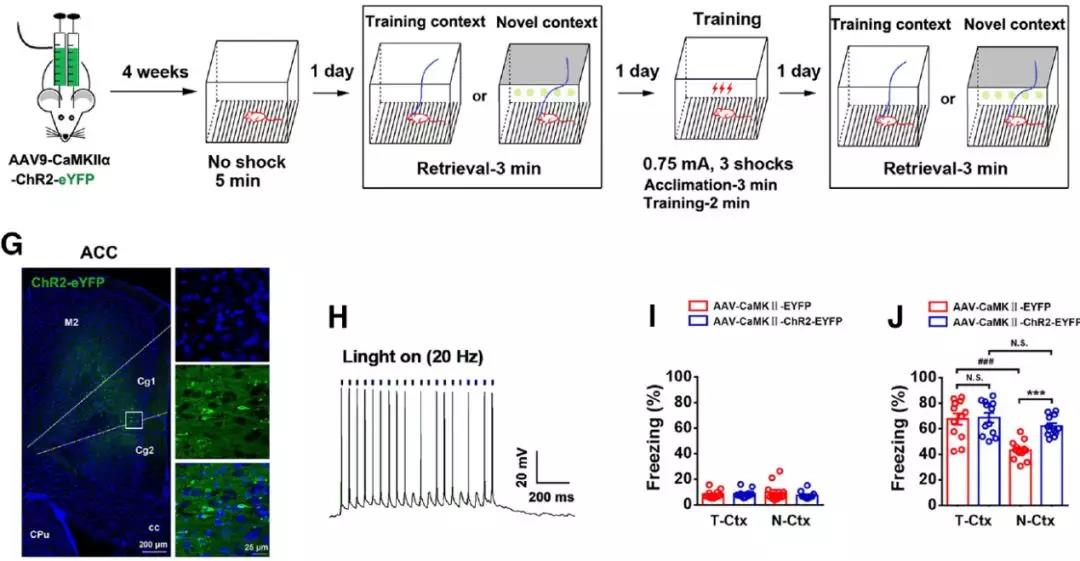
2. 抑制前扣带皮层和腹侧海马活性可显著抑制远期恐惧记忆的泛化:作者通过化学遗传学的手段分别在前扣带皮层、背侧海马和腹侧海马注射了化学遗传病毒AAV9-hSyn-HA-hM4Di-IRES-mCitrine(上海吉凯基因),在腹腔注射CNO时能够特异性抑制被病毒感染脑区的神经元活性。实验结果表明,特异性抑制前扣带皮层和腹侧海马的神经活性能够显著抑制恐惧记忆的远期泛化,而特异性抑制背侧海马的神经活性对于恐惧记忆的远期泛化并无明显影响,但是会显著抑制小鼠在造模环境的恐惧记忆的巩固。此外,为了进一步证明该结论,作者在前扣带皮层注射光遗传学病毒AAV9-CaMKII-ChR2-EYFP(上海吉凯基因),在给予465 nm蓝光照射时能够特异性激活感染病毒的神经元,兴奋前扣带皮层。在恐惧记忆造模1天后,特异性激活前扣带皮层能够使得恐惧记忆产生泛化,这充分证明了前扣带皮层神经元活性在介导恐惧记忆远期泛化中的关键作用。
研究结论
本研究首次发现ACC与vHPC之间的神经投射关系以及ACC至vHPC的神经环路对于恐惧记忆的泛化起着关键性作用:ACC和vHPV都参与恐惧记忆泛化的过程,ACC至vHPC有神经投射,且该投射的过度激活会导致恐惧记忆的泛化。这一神经环路的发现不仅诠释了恐惧记忆远期泛化的神经机制更为临床创伤后应激障碍的治疗提供了理论依据和应用基础。
吉凯腺相关病毒:
助力化学遗传和光遗传研究
化学遗传抑制和光遗传腺相关病毒AAV9-hSyn-HA-hM4Di-IRES-mCitrine、AAV9-CaMKII-ChR2-EYFP由上海吉凯基因提供。通过感染脑区神经元,注射CNO或给予特定波长光照来抑制和激活神经元的活性。

作者简介
南京医科大学药学院朱东亚教授为本文通讯作者。南京医科大学药学院卞新兰硕士、秦城博士和蔡成云博士为本文共同第一作者。
朱东亚,男,1956年11月出生,博士,教授,博士生导师。南京医科大学药学学科带头人、南京医科大学药学院院长。2001年获中国药科大学药理学博士学位。2001-2003加拿大卡尔加里大学医学院博士后。主持科技部重大科技专项、国家自然科学基、江苏省自然科学基金重点项目及重大技术创新等10余项科研项目,在SCI收录国际学术刊物发表研究论文30余篇,申请国家发明**10余项。
想要了解更多资讯,欢迎关注公众号【病毒实验帮】~为您实时更新前沿信息!
