胰腺导管腺癌 (PDAC) 具有复杂的肿瘤微环境 (TME),由丰富的基质细胞组成。其中,肿瘤浸润T细胞在肿瘤进展中起着举足轻重的作用。2022年,北京大学第一医院普外科的研究人员对PDAC T细胞的发育、恶性导管细胞的异质性以及T细胞和恶性导管细胞之间的CCL5-SDC1/4受体-配体相互作用进行了研究。

为了在导管细胞中区分恶性和非恶性细胞,作者用到了inferCNV。简单来说,InferCNV可用于鉴定肿瘤单细胞RNA-Seq数据中大规模染色体拷贝数变异,例如整个染色体或大片段染色体的扩增或缺失。基本思路是在整个基因组范围内,将每个肿瘤细胞基因表达与平均表达或“正常”参考细胞基因表达对比,确定其表达强度。接下来,小编就带大家看下inferCNV在这篇文章中是如何使用的。
为了描绘PDAC和正常胰腺组织的细胞,作者取了六名PDAC患者的四个癌和癌旁样本进行了scRNA-seq。共鉴定出13种已知细胞类型(图1B),包括T细胞 (CD2,CD3D),成纤维细胞 (LUM),巨噬细胞 (AIF1,CD68),导管细胞 (KRT19),内皮细胞 (CDH5),星状细胞 (RGS5),腺泡细胞 (PRSS1),B细胞 (MS4A1),浆细胞 (MZB1),肥大细胞 (CPA3),中性粒细胞 (G0S2,S100A8),雪旺细胞 (GAP43),和内分泌细胞 (CHGA) 。
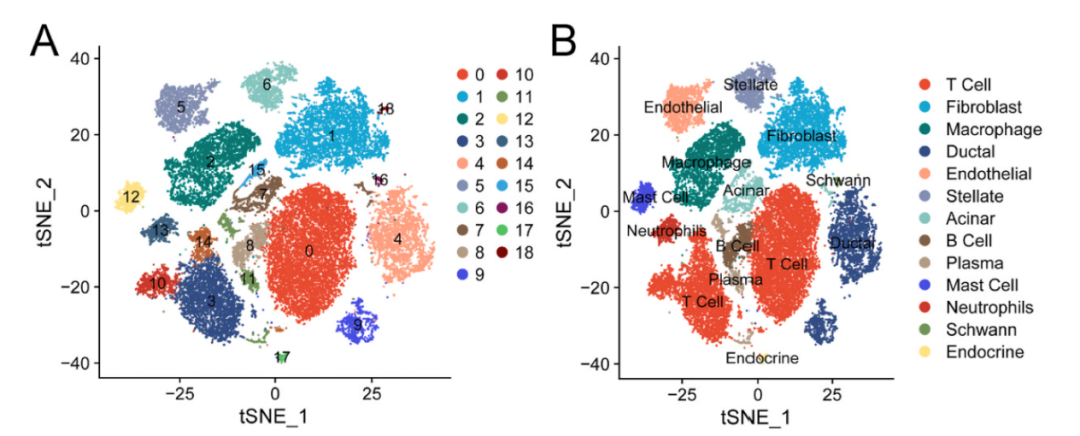
图1.scRNA-seq描绘了PDAC中的细胞。(A-B) t-SNE图显示PDAC和邻近的非癌组织中的主要细胞类型。每个点代表一个细胞,细胞类型用不同的颜色编码。
为了构建新的基因细胞基质,作者对导管细胞进行了亚分群分析,得到了8个簇 (图2A)。为了进一步鉴定PDAC中的恶性导管细胞,作者基于inferCNV推断了导管细胞中大规模染色体拷贝数变异 (CNV) 并计算了每个导管细胞簇的CNV分数。T细胞,巨噬细胞和内皮细胞被用作参考细胞。结果表明簇2/3/5/6的CNV得分显著高于参考细胞,并且它们具有不同的染色体拷贝数变异模式 (图2B-C)。而簇1/4/7/8和参考细胞之间的CNV得分没有显著差异。因此,作者将簇2/3/5/6定义为恶性导管细胞 (肿瘤1-4),将簇1/4/7/8定义为正常导管细胞 (导管1-4)。
作者比较了所有导管簇中肿瘤细胞已知的标记基因 (图2D)。肿瘤标记基因,包括CEACAM1,CEACAM6,LAMC2和MSLN在所有肿瘤簇中高度表达,而CEACAM5,TFF1和TFF2在某些肿瘤簇中富集。值得注意的是,每个肿瘤簇(肿瘤1-4) 分别仅来自一个样本,而正常导管簇 (导管1-4) 来自各种样本,表明患者间PDAC中肿瘤细胞的异质性。
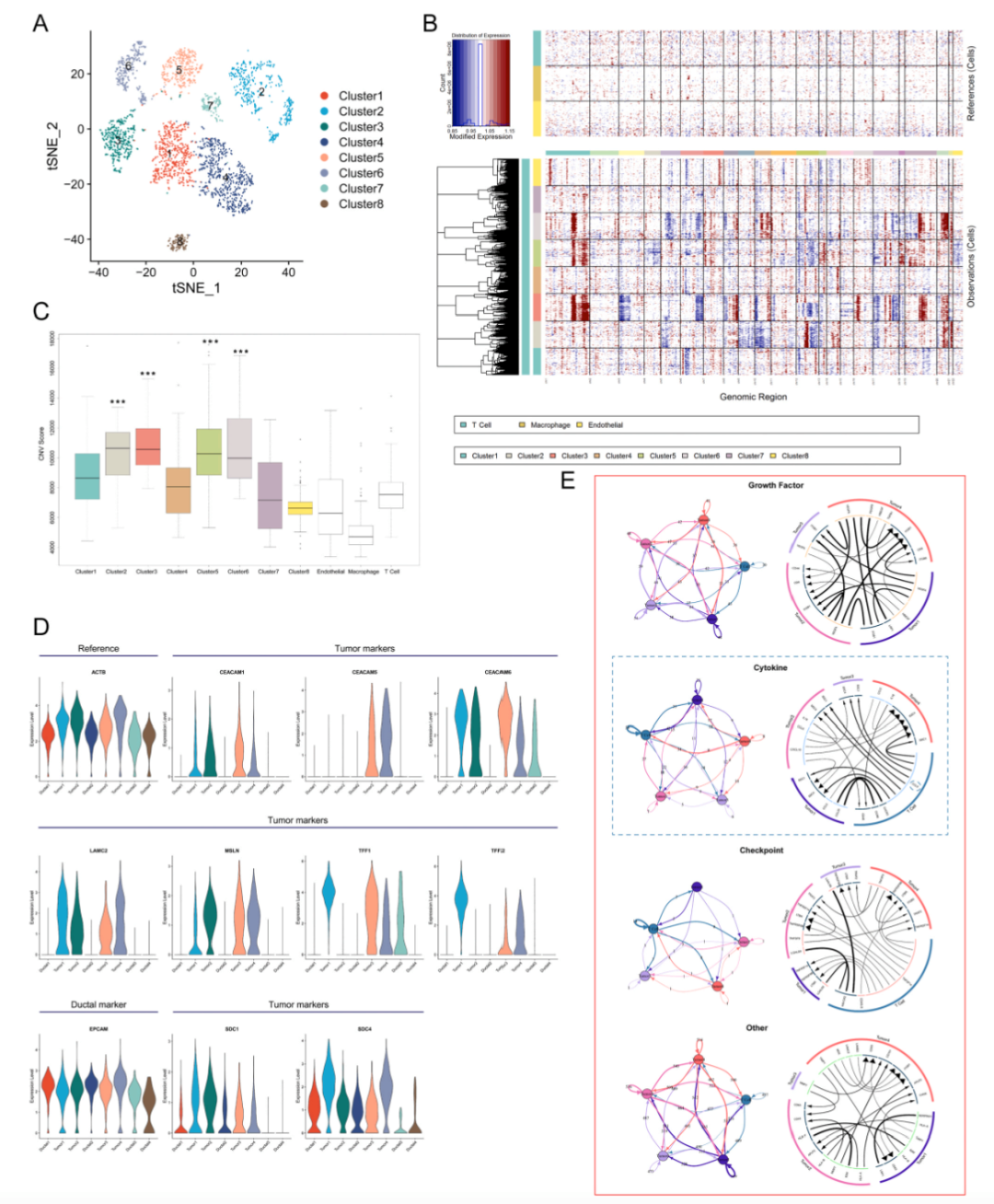
图2.恶性导管细胞的鉴定及其与PDAC中T细胞的细胞通讯。(A) 导管细胞亚群的t-SNE图。树结构中的每个点代表一个细胞,细胞类型用不同的颜色编码。(B) 热图显示每个导管细胞簇的大规模CNV分布,正常细胞的表达值绘制在顶部,用作参考细胞,基因在整个染色体上从左到右排列,红色和蓝色分别代表高CNV和低CNV水平。T细胞、巨噬细胞和内皮细胞被定义为参考细胞。(C) 显示不同导管细胞簇的CNV分数的箱式图。白框代表参考细胞。(D) 小提琴图显示了不同导管细胞亚群的肿瘤标志物基因的表达水平。(E) 显示了肿瘤细胞和T细胞之间的受体-配体对。
基于以上工具,作者对恶性和非恶性细胞进行了区分,并分别探究了恶性和非恶性的特征。除此以外,作者还对肿瘤进展起重要作用的T细胞进行了亚群分析和发育轨迹分析,并预测了T细胞和恶性导管细胞之间的CCL5-SDC1/4受体-配体相互作用,证明了CCL5在体外通过与SDC1相互作用来推动肿瘤细胞的迁移。这些发现为表征PDAC TME中T细胞的异质性和发育轨迹以及细胞间通讯铺平了道路,可能为免疫治疗提供新的靶标。
