外泌体是从活细胞释放到细胞外微环境的50-150 nm大小的囊泡。根据国际细胞外囊泡(ISEV)2018年的提议,外泌体鉴定方法包括透射电子显微镜(TEM),纳米视粒度分析仪和蛋白质标记。
随着对外泌体的深入了解,其临床应用越来越受到关注。肿瘤来源的外泌体或TDEx(肿瘤来源的细胞外囊泡)调节肿瘤的微环境并协助远处转移。外泌体或TDEx上的分子标记使其成为用于癌症诊断和预后监测的有效液体活检指标。
一、外泌体组分
外泌体的纳米球膜型结构由双层脂质形成。它也由各种类型的脂质和蛋白质组成,这些脂质和蛋白质衍生自形成外泌体的亲代细胞。根据外泌体数据库ExoCarta的资料,目前已知约有8000种蛋白质和194种脂质与外泌体相关。

二、外泌体生物学功能
外泌体通过生物体液被多种不同类型的细胞分泌,包括滑膜液,母乳,血液,尿液,唾液,羊水和血液中的血清,这表明它们在细胞间通讯和触发生理反应中起着重要的作用。外泌体功能的首次发现是参与细胞成熟过程中去除不必要的蛋白质。简而言之,它们是天然膜囊泡,将蛋白质,RNA,DNA和脂质从一个细胞携带到另一个细胞,从而调节受体细胞的生物功能。
••在心血管系统中,据报道,源自人胚胎干细胞(ESC)的间充质干细胞(MSC)外泌体可减少小鼠和猪模型中的心肌缺血和再灌注损伤;
••在免疫系统中,据报道趋化因子受体CCR5通过外泌体在细胞之间转移是细胞人类免疫缺陷病毒感染的一种机制;2018年发表在Nature的Exosomal PD-L1 contributes to
immunosuppression and is associated with anti-PD-1 response文章报道了转移性黑素瘤释放的外泌体在其表面携带PD-L1,通过干扰素-c(IFN-c)的刺激会增加PD-L1的携带量,从而导致CD8 T细胞功能的抑制,促进肿瘤生长。
•在中枢神经系统(CNS)中,外泌体的作用是消除废物并介导大脑活动,从而抑制神经退行性疾病的发病机理;
迄今为止,尚未完全发现调节外泌体-细胞结合的途径。然而,很明显,其结合过程从外泌体识别受体细胞PM上的特定受体开始。膜受体的识别是外泌体细胞反应的基础,它可能激活受体并随后导致相关信号通路的激活,外泌体与PM融合或外泌体的内吞作用,从而导致蛋白质和RNA直接释放到受体细胞中。
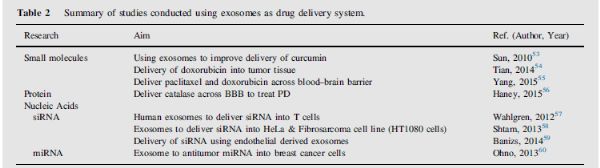
三、外泌体递送药物载体
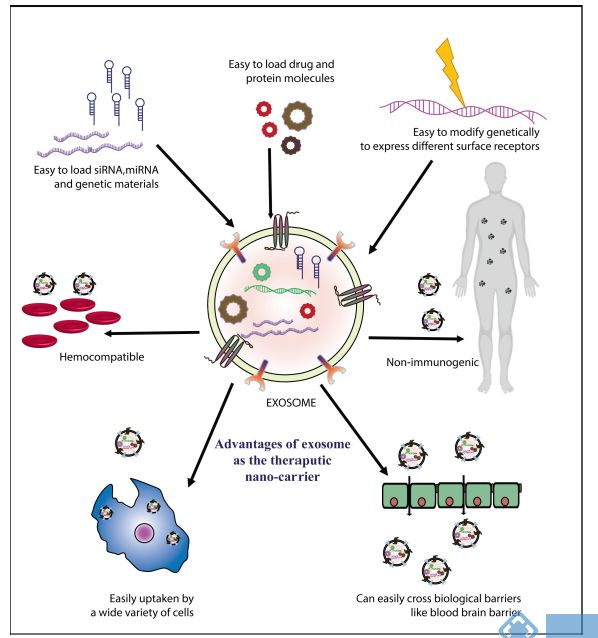
外泌体最有用的特性之一是它们穿过屏障(如细胞质膜和血/脑屏障)的能力。 这使它们成为理想的治疗传递分子。外泌体由于其天然的材料运输特性,固有的长期循环能力和出色的生物相容性而具有很大的潜力成为药物递送载体,其适合于递送各种化学物质,蛋白质,核酸和基因治疗剂。
(1)
外泌体作为小分子的药物传递载体
关于外泌体递送姜黄素,多巴胺,PTX和DOX等化学治疗药物的报道已有充分文献记载。
2010年发表在Molecular therapy的文章A novel nanoparticle drug delivery system: the antiinflammatory
activity of curcumin is enhanced when encapsulated in exosomes介绍姜黄素包裹在囊泡中的抗炎活性比单独递送时强三倍以上。
2014年发表在Biomaterials的文章A doxorubicin delivery platform using engineered natural membrane
vesicle exosomes for targeted tumor therapy通过电穿孔将DOX加载到iRGD肽功能化的外泌体上载药效率高达20%。重要的是,由于存在iRGD肽,外泌体在体外和体内均显示出高的肿瘤靶向能力和抗肿瘤功效。
2014年发表在Journal of controlled release的文章Paclitaxel is incorporated by mesenchymal stromal cells and released
in exosomes that inhibit in vitro tumor growth: a new approach for drug
delivery介绍PTX可以成功加载到MSC衍生的外泌体中,从而显着抑制人胰腺细胞的生长。
姜黄素包裹在囊泡中的抗炎活性比单独递送时强三倍以上
(2)
外泌体作为蛋白质的药物递送载体
已经发现外泌体可递送多种蛋白质,例如酶,细胞骨架蛋白质和跨膜蛋白质。2018年发表在Journal of controlled release的文章Comparison of exosomes and ferritin protein nanocages for the
delivery of membrane protein therapeutics比较了使用外泌体和一种铁蛋白纳米笼(nanocages)在递送信号调节蛋白a(CD47的拮抗剂)的功效。他们得出结论,由于巨噬细胞增强了吞噬作用,外泌体诱导的肿瘤生长抑制作用比纳米笼诱导的抑制作用高。
(3)
外泌体作为核酸的药物递送载体
研究表明,外泌体天然的可以携带遗传(例如miRNA,siRNA)到靶细胞中,从而在生物学和致病过程中诱导遗传修饰。外泌体的这些特征已成为涉及遗传疗法和使用外泌体进行研究的主要策略。
---siRNA递送:siRNA的稳定性低,在体内循环中易于降解。外泌体可作为治疗性载体,帮助保护siRNA并将其递送至靶细胞。
---miRNA递送:已知外泌体天然携带miRNA,因此将外泌体用作将miRNA传递至靶细胞的治疗载体是合乎逻辑的。2013年发表在Molecular therapy的文章Systemically injected
exosomes targeted to EGFR deliver antitumor microRNA to breast cancer cells使用外泌体传递靶向乳腺癌细胞中表皮生长因子受体(EGFR)的miRNA let-7a。
四、外泌体给药途径
给药途径是获得所需功效的重要参数。外泌体可以通过多种方法给药,但是,静脉内给药是最常用的途径。通过利用增强通透性和保留(EPR)效应,在荷瘤动物中静脉内递送外来体似乎是有用的。在某些容易达到肿瘤部位的不同恶性肿瘤中,外泌体疗法的给药途径是瘤内注射。在疾病部位直接注射外泌体的优点是可以特异性地运送装载的药物。另外口服给药,腹腔给药,皮内给药和鼻内给药途径已成功用于外泌体递送。
五、外泌体递送药物的优势
许多新的候选药物(例如蛋白质和核酸)在体内环境中高度不稳定,对治疗结果的效果提出了重大挑战。鉴于与许多当前的纳米微粒递送系统相关的问题,外泌体作为“自然的递送系统”允许递送这些生物分子。由于外泌体体积小和其本身就是细胞产物,通过外泌体递送药物可以避免巨噬细胞的吞噬作用或降解,还可以在体内长时间循环,保持效果。其中,外泌体能够穿过血脑屏障以将特定药物输送到中枢神经系统是外泌体递送药物的一个显著优势。
六、结语
外泌体为细胞疗法中的不同合成分子和生物分子的递送提供了广阔的前景和崭新的治疗领域。外泌体还显示出了在治疗各种疾病(如心肌病,癌症和神经病)方面的潜力。但是,在实际应用外泌体之前,需要使用大型动物模型进行进一步研究和临床试验。同时需要开发大规模生产质量可控的外泌体并快速纯化外泌体的技术和策略。另外,在研究和评估外泌体的副作用和功效时,必须考虑到肿瘤细胞来源的外泌体可能增强肿瘤生长的潜在风险。