

2021年FDA批准上市8款抗体新药辅料种类统计
近年来,抗体药物作为生物制剂领域的重要分支,发展势头迅猛,市场潜力巨大,引得无数医药企业加大投入,加快研发。2021年,FDA共批准8款抗体新药,其中5款为单抗药物,2款为ADC药物,1款为双抗药物;目前FDA已累计批准107款抗体新药。
本文将从整体分析及详细信息两个方面,对这8款抗体新药的制剂处方进行深度分析。
一、 整体分析
1.氨基酸类辅料
由上表可见,8款抗体新药中均使用了氨基酸辅料。
氨基酸可以通过多种机制稳定蛋白,包括优先水合、与蛋白相结合以及增强体系缓冲能力或抗氧化能力等。作为药物辅料,用于稳定蛋白的常用氨基酸有组氨酸,精氨酸等。
8款抗体新药中,6款用到了组氨酸(histidine,His),组氨酸被广泛用作蛋白(如抗体)的缓冲剂,不仅可控制溶液的pH值,在固态剂型中还可提供稳定抗体的非共价相互作用。
此外,组氨酸还是一种抗氧化剂,可清除溶液中的自由基。
3款抗体新药用到了精氨酸(Arginine,Arg),精氨酸被广泛用作蛋白纯化步骤(例如包涵体回收)中的增溶剂,分析尺寸排阻色谱法中的流动相成分和药物辅料。
用于稳定蛋白的其他氨基酸还包括甲硫氨酸,脯氨酸等,在上述抗体新药的处方中也有应用。
2. 保护剂
8款抗体新药中,有4款制剂处方中使用到了糖类辅料。 糖经常用作药物辅料,以稳定液体和冻干制剂中的蛋白。
蔗糖和海藻糖是自然界中用于在恶劣环境条件(例如高温和低水环境)下稳定微生物细胞结构的渗透压调节剂,被认为可以通过在液态高浓度时优先水合来稳定蛋白,在固态时通过特异性相互作用与蛋白相结合和高粘性玻璃状基质的形成来稳定蛋白。
8款抗体新药中,剂型为冻干粉的Zynlonta和Tivdak均选择了蔗糖作为冻干保护剂。液体剂型中,Saphnelo选用海藻糖,Rybrevant选用蔗糖作为蛋白保护剂。
此外,甘露醇通常在冻干制剂中用作填充剂,但由于其在冷冻过程中会结晶,因此几乎无法直接稳定蛋白。甘露醇(填充剂)和蔗糖(冻干保护剂)混合使用是一种冻干和储存蛋白药物的有效策略,Tivdak正是采用了蔗糖+甘露醇用于冻干粉剂的制作。
需要指出的是,某些糖类辅料可能降解或含有杂质,可能对蛋白稳定性造成不利影响。例如,蔗糖会水解成葡萄糖和果糖,形成还原糖,从而导致赖氨酸残基的蛋白糖化。据报道,这些糖化反应甚至在冻干蛋白制剂的储存过程中以固态发生。相比之下,不具有还原性、高玻璃化转变温度、高酸碱稳定性、天然双糖中最稳定的海藻糖,作为保护剂正获得越来越广泛的应用。
关于海藻糖作为蛋白保护剂/冻干保护剂的机制、优势与案例,可参考笔者之前整理的推文:
《海藻糖对蛋白的保护机理——通过不同糖对纤维素酶保护的机理研究分析》
《海藻糖为什么是优秀的冻干保护剂——从玻璃化转变温度说起》
3. 缓冲盐
氨基酸残基的化学完整性和蛋白高级结构的维持高度依赖于溶液的pH值。缓冲剂可用于控制溶液的pH值并优化蛋白稳定性,包括醋酸盐、柠檬酸盐、磷酸盐、Tris等,其pH范围约为3-10。在给定的溶液pH值下,不同的缓冲离子会对蛋白的化学和构象稳定性产生特定的离子影响。
一些缓冲剂在制剂处方中会表现出一些独特的性质。如柠檬酸盐会影响蛋白溶解度并导致一些高浓度单克隆抗体凝胶化,Tris和磷酸盐缓冲液的pH值会分别随着温度和冷冻而变化。还有一些缓冲离子在储存过程中会分解,其降解物会相互作用并破坏蛋白的稳定性,比如暴露于痕量金属及光照的柠檬酸盐缓冲液。因此,根据抗体药物的特性选择适宜的缓冲体系,对建立一个优秀的制剂处方十分重要。
4. 表面活性剂
非离子表面活性剂通常用于蛋白制剂中,以抑制由于搅拌或摇动而引起的蛋白聚集。非离子表面活性剂稳定蛋白的能力主要归因于它们在疏水性表面(如空气-水界面)上的竞争能力超过蛋白分子,从而防止蛋白在这些疏水性界面上解折叠。非离子表面活性剂还可以阻止蛋白分子吸附到加工过程中存在的其他疏水表面上。
聚山梨酯20(PS20)和聚山梨酯80(PS80)是蛋白配方中最常用的两种非离子表面活性剂辅料。PS20和PS80均被证明可以保护蛋白免受搅动诱导的聚集以及抵抗冷冻,冻干和复溶所诱导的蛋白聚集。不过,PS20和PS80都可能含有会氧化蛋白的过氧化物。另外,PS20和PS80都可能因氧化或水解而降解,从而对蛋白的稳定性产生不同的影响。由于PS20和PS80在膜过滤过程中的复杂行为(尤其是在聚山梨酸酯在溶液中形成胶束的浓度),因此控制PS20和PS80的含量也很困难。
二、 详细信息
8款抗体新药的制剂处方详细信息如下。
1.Evkeeza
Evkeeza为靶向ANGPTL3的降血脂FIC新药,由再生元研发。
Evinacumab-dgnb是一种血管生成素样蛋白3 (ANGPTL3)抑制剂单克隆抗体(IgG4同型),通过重组DNA技术在中国仓鼠卵巢(CHO)细胞悬浮培养获得,分子量约为146 kDa。
EVKEEZA (evinacumab-dgnb)注射剂是一种无菌、无防腐剂的静脉注射用溶液。溶液清澈至微乳白色,无色至淡黄色,无可见颗粒。每瓶含有345mg/2.3 mL或1200mg/8mL溶液,pH值为6。
制剂处方信息如下:

2.Jemperli
Dostarlimab为FDA批准的第4款PD-1抗体,最初由Anaptysbio研发,为首个动物细胞展示平台技术来源的抗体药物。药明生物为Dostarlimab提供CMO服务。
Dostarlimab-gxly是一种PD-1阻断IgG4人源化单克隆抗体。Dostarlimab-gxly在中国仓鼠卵巢细胞中产生,分子量约为144 kDa。
Jemperli(dostarlimab-gxly)是一种无菌、透明至微乳白色、无色至黄色的溶液,基本上没有可见颗粒,每瓶10mL。
制剂处方信息如下:

3.Zynlonta
Zynlonta是首个CD19 ADC新药,由ADC Therapeutics研发,采用PBD毒素和SG3249连接子。
Loncastuximab tesirine-lpyl是一种CD19指向的抗体和烷基化剂偶联物,由人源化IgG1 kappa单克隆抗体通过蛋白酶可裂解的缬氨酸-丙氨酸连接子偶联到吡罗苯二氮(PBD)二聚体细胞毒性烷基化剂SG3199。连接到连接器上的SG3199被称为SG3249,也称为tesirine。
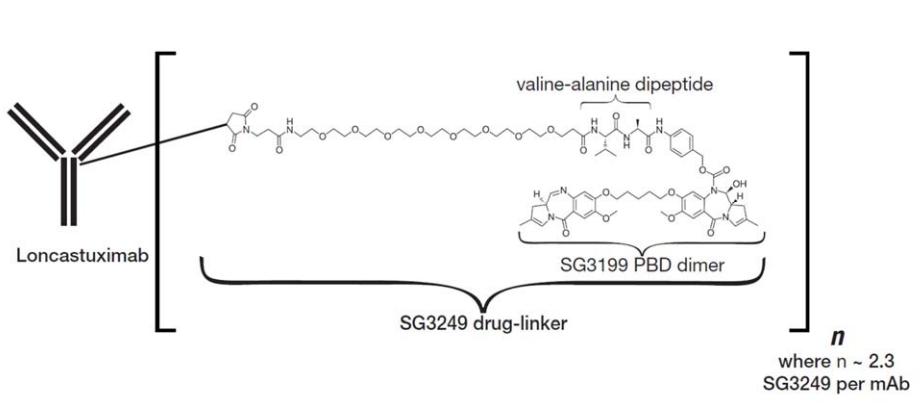
(https://www.accessdata.fda.gov/drugsatfda_docs/label/2021/761196s000lbl.pdf)
Loncastuximab tesirine-lpyl的分子量约为151kDa。每个抗体分子上平均附着2.3个SG3249分子。Loncastuximab tesirine-lpyl是抗体和小分子成分通过化学偶联形成的。其中抗体由哺乳动物(中国仓鼠卵巢)细胞产生,小分子成分通过化学合成产生。
ZYNLONTA (loncastuximab tesirine-lpyl)是一种无菌,白色至米白色,不含防腐剂的冻干粉末,外观像蛋糕,在重溶和稀释后用于静脉注射。每个单剂量瓶用2.2mL无菌注射用水复配后,最终浓度为5mg/mL, pH约6.0。
制剂处方信息如下:

4.Rybrevant
Rybrevant为FDA批准第3款双抗,用于治疗EGFR20外显子插入突变的NSCLC。
Amivantamab-vmjw是一种低聚焦的基于人免疫球蛋白g1的双特异性抗体,针对EGF和MET受体,由哺乳动物(中国仓鼠卵巢CHO)细胞使用重组DNA技术生产,分子量约为148kDa。
Rybrevant (amivantamab-vmjw)静脉输液注射剂是一种无菌、无防腐剂、无色至淡黄色的单剂量瓶溶液。pH值为5.7。
制剂处方信息如下:

5. Aduhelm
Aduhelm为Aβ单抗,是FDA2003年以来批准的首个阿尔茨海默症药物。但临床疗效存在争议,受到医生的普遍抵制,2021年前三季度销售额仅200万美元,其中三季度销售额仅30万美元。
Aducanumab-avwa是一种重组人免疫球蛋白γ 1 (IgG1)单克隆抗体,针对的是聚集的可溶性和不溶性β淀粉样蛋白,在中国仓鼠卵巢细胞系中表达,分子量约为146 kDa。
Aduhelm (aducanumab-avwa)注射剂是一种无防腐剂,无菌,透明至乳白色,无色至黄色的溶液,稀释后供静脉滴注,浓度为170mg/1.7mL或300mg/3mL(100 mg/mL),pH约为5.5。
制剂处方信息如下:

6.Saphnelo
Anifrolumab为贝利木单抗之后10年来第一款狼疮新药,其开发之路颇为坎坷, 2019年,Anifrolumab的第2项三期临床宣告成功。国内方面,智翔金泰和荃信生物的IFNAR1抗体已经申报临床。
anfrolumab-fnia是一种I型干扰素(IFN)受体拮抗剂,免疫球蛋白G1κ (IgG1κ)单克隆抗体,通过重组DNA技术在小鼠骨髓瘤细胞(NS0)中产生,分子量约为148kDa。
Saphnelo (anifrolumab-fnia)注射液是一种无菌,无防腐剂,透明至乳白色,无色至微黄色,供静脉注射使用的溶液。SAPHNELO含有的anfrolumab-fnia浓度为150mg/mL,单剂量瓶,每瓶2mL。pH为5.9。
制剂处方信息如下:
7.Tivdak
Tisotumab Vedotin为靶向组织因子(TF)的FIC药物,二期临床表现出优异的疗效。国内方面,乐普生物研发了国内首个TF ADC,今年2月获得FDA批准临床,6月在国内递交临床试验申请。
Tisotumab vedotin-tftv是一种组织因子(TF)定向抗体药物偶联物(ADC),由人抗TF IgG1-kappa抗体通过蛋白酶可切割vc(缬氨酸-瓜氨酸)连接子偶联到微管破坏剂单甲基auristatin E (MMAE)。该单克隆抗体是在一种哺乳动物细胞(中国仓鼠卵巢细胞)中产生的。MMAE和连接剂通过化学合成获得。每个单克隆抗体分子平均携带4个MMAE分子。Tisotumab vedotin-tftv的分子量约为153 kDa。其化学结构如下:
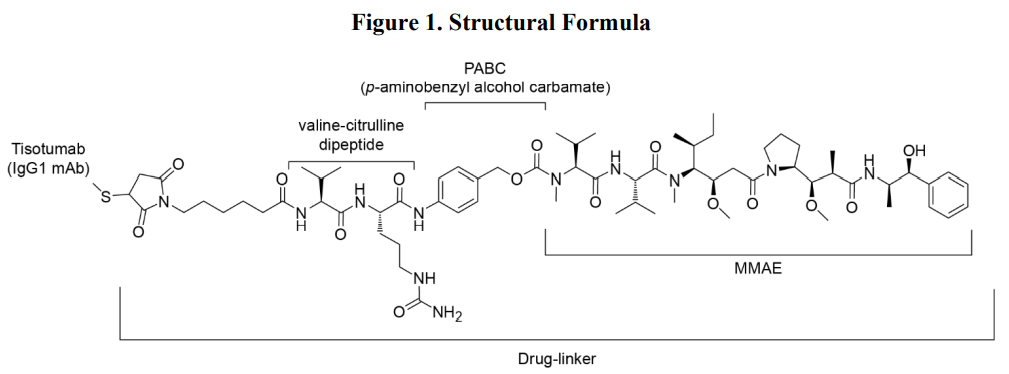
(https://www.accessdata.fda.gov/drugsatfda_docs/label/2021/761208Orig1s000lbledt.pdf)
Tivdak (tisotumab vedotin-tftv)供注射用,为无菌、无防腐剂、白色或灰白色的冻干饼或粉末,单剂量瓶,稀释后用于输注。用4mL无菌注射用水复配后,制备出含10mg/mL tisotumab vedotin-tftv的清澈至微乳白色、无色至棕黄色溶液,pH为6.0。
制剂处方信息如下:

8.Tezspire
Tezspire的研发也颇为曲折,2020年11月10日,阿斯利康宣布TSLP抗体Tezepelumab的三期临床NAVIGATOR获得成功。2020年12月22日,阿斯利康宣布Tezepelumab的第二项三期临床SOURCE失败。这两项三期临床的主要终点标准不同,SOURCE的主要终点为口服激素减少的剂量。NAVIGATOR的主要终点为AAER的下降。虽然不能减少激素用量,但Tezepelumab降低AAER的效果还是非常显著的,因此顺利获得FDA批准上市。
Tezepelumab-ekko是一种胸腺基质淋巴细胞生成素(TSLP)阻断剂,是一种利用重组DNA技术在中国仓鼠卵巢(CHO)细胞中产生的人单克隆抗体免疫球蛋白G2λ (IgG2λ)。Tezepelumab-ekko的分子量约为147 kDa。
Tezspire (tezepelumab-ekko)注射剂是一种无菌,无防腐剂,透明到乳白色,无色到淡黄色的溶液,用于皮下注射,以单剂量瓶或单剂量预充注射器的形式提供使用,每个单剂量瓶或预充注射器包含1.91 mL溶液,pH为5.2。
制剂处方信息如下:

三、总结
如果说抗体蛋白是抗体药物的先头主战队伍,那么制剂中的各类辅料就是后勤保障队伍。古语有云,“兵马未动,粮草先行”,倘若缺了后勤,再精锐的战士也难以发挥出战斗力。而一个优秀的制剂处方,就如同一个与主力队伍配合无间的后勤体系,对于确保抗体药物从生产到储运到使用全过程的稳定性、溶解性和渗透性等,无疑发挥着极为重要的作用。
蛋白制剂开发工作中的一项重大挑战,便是基于对蛋白分子稳定性的透彻理解来合理设计、优化剂型、含量,并研究不同的药物辅料对蛋白稳定性的影响。但是由于药用辅料多种多样,需评估各种不同的组合和浓度,如果进行全面筛选,所需的物料成本、人力成本、时间成本等过高,显然不具有可行性。
然而临床研究时间和成本的限制通常要求制剂人员尽快制作出稳定的制剂并用于临床试验。因此,对于成熟制剂处方进行学习分析,无疑可以帮助制剂人员进行辅料选择,加快处方确定。
2014年后,全球抗体新药发展迅速,目前研发的抗体药物呈现多样化趋势,如ADC药物与单/双/多特异性抗体、纳米抗体等形式的抗体不断增加,以抗肿瘤和抗风湿类免疫疾病为核心应用领域,并开始在其他领域发力。
笔者希望通过分析2021年FDA批准上市的8款抗体新药的处方信息,为相关制剂研发及工艺人员提供一定的参考与帮助。
如果您对本文有任何疑问或建议,欢迎您通过留言或私信与我们交流,艾伟拓将持续为广大客户提供高端药用辅料及配套的优质服务!
艾伟拓长期稳定供应注射级蔗糖海藻糖,超低内毒素,符合各国药典标准,助力产品中外申报!


