免疫荧光【染色技术问题全解析】
产品名称: 免疫荧光【染色技术问题全解析】
英文名称: Immunofluorescence technique
产品编号:
产品价格: 详询【热线】19931682702
产品产地: null
品牌商标: null
更新时间: null
使用范围: null
- 联系人 : 石老师
- 地址 : 河北固安肽谷生物医药产业园A7栋
- 邮编 :
- 所在区域 : 北京
- 电话 : 199****2702 点击查看
- 传真 : 点击查看
- 邮箱 : 2177827493@qq.com
免疫组织化学技术——免疫荧光方法
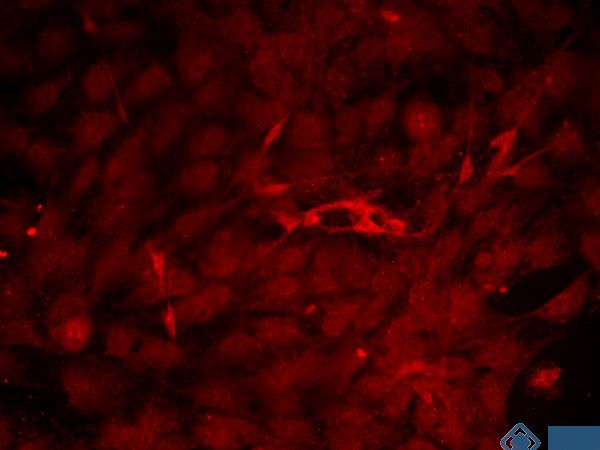
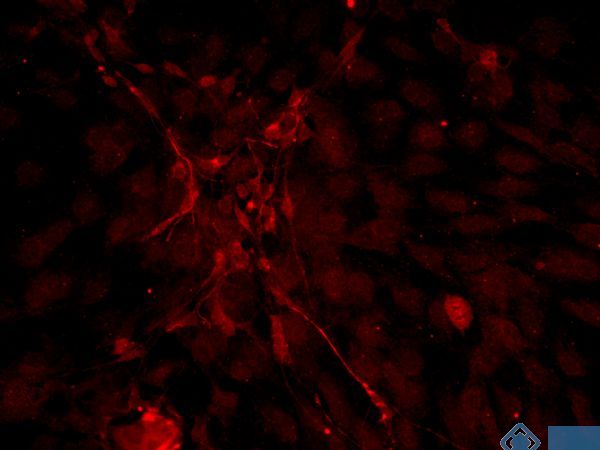
免疫荧光方法是免疫组织化学技术的开端。它利用抗原抗体特异性结合的原理,先将已知抗体标上荧光素,以此作为探针检查细胞或组织内的相应抗原,在荧光显微镜下观察。当抗原抗体复合物中的荧光素受激发光的照射后即会发出一定波长的荧光,从而可确定组织中某种抗原的定位,进而还可进行定量分析。MDL实验的免疫荧光技术特异性强、灵敏度高、快速简便,所以在临床病理诊断、检验中应用较广,可以让您的实验结果更清晰明了。
注意:
(1)单独冲洗,防止交叉反应造成污染。
(2)温柔冲洗,防止切片的脱落。我喜欢用浸洗方式;
(3)冲洗的时间要足够,才能彻底洗去结合的物质。
(4)PBS的PH和离子强度的使用和要求(建议PH在7.4-7.6,浓度是0.01M;中性及弱碱性条件有利于免疫复合物的形成,而酸性条件则有利于分解;低离子强度有利于免疫复合物的形成,而高离子强度则有利于分解)
(5)拍照:有条件的话更好立即拍照,若不能及时拍照,也要封好片和用指甲油封固,保持避光和湿度。使用荧光显微镜注意严格按照荧光显微镜出厂说明书要求进行操作,不要随意改变程序;应在暗室中进行检查;防止紫外线对眼睛的损害,在调整光源时应戴上防护眼镜;检查时间每次以1~2h为宜,超过90min,超高压汞灯发光强度逐渐下降,荧光减弱;标本受紫外线照射3~5min后,荧光也明显减弱或褪色;激发光长时间的照射,会发生荧光的衰减和淬灭现象;所以最多不得超过2~3h;荧光显微镜光源寿命有限,标本应集中检查,以节省时间,保护光源。天热时,应加电扇散热降温,新换灯泡应从开始就记录使用时间。灯熄灭后欲再启用时,须待灯光充分冷却后才能点燃。中应避免数次点燃光源。关闭汞灯至少在开启15-30分钟后;标本染色后立即观察,因时间久了荧光会逐渐减弱。若将标本放在聚乙烯塑料袋中4℃保存,可延缓荧光减弱时间,防止封裱剂蒸发;使用的玻片等载体,都必须厚度均匀,无明显的自发荧光,如果使用油镜,还必须保证镜油为无荧光镜油;电源更好装稳压器,否则电压不稳不仅会降低汞灯的寿命,也会影响镜检的效果。
背景染色较深的原因有哪些?
1、抗体浓度过高:一抗浓度过高是常见的原因之一。解决办法是,每次使用新抗体前应当对其工作浓度进行测试,使每一抗体个体化,找到适合自己实验室的理想工作浓度,既使是即用型的抗体也应如此,不能只简单的按说明书进行染色。
2、抗体孵育时间过长或温度较高:解决办法是,严格执行操作规程,更好随身佩带报时表或报时钟,及时提醒,避免因遗忘而造成时间延长。现在流行的二步法(Polymer)敏感性很高,要求一抗孵育的时间不是传统的1小时,而是30分钟,因此,要根据染色结果进行调整。
3、DAB变质和显色时间太长:DAB更好现用现配,如有沉渣应进行过滤后再用。配制好的DAB不应存放时间太长,因为在没有酶的情况下,过氧化氢也会游离出氧原子与DAB产生反应而降低DAB的效力,未用完的DAB存放在冰箱里几天后再用这种似乎节约的办法是不可取的。DAB的显色更好在显微镜下监控,达到理想的染色程度时立即终止反应。不过当染色片太多时或用染色机时,这样做似乎不现实,但至少应对一些新的或少用的抗体显色时进行监控,避免显色时间过长。
4、组织变干:修复液溢出后未及时补充液体、染色切片太多、动作太慢、忘记滴液、滴液流失等都是造成组织变干的原因。解决的办法是操作要认真仔细,采用DAKO笔或PAPPen在组织周围画圈,可以有效的避免液体流失,也能提高操作速度。
5、切片在缓冲液或修复液中浸泡时间太长(大于24小时):原因上不清楚,但现象存在。有的实验室喜欢前将切片脱蜡至修复,第二天加抗体进行免疫组化染色,如果将装有切片和修复液的容器放在4oC冰箱过夜,对结果无明显影响,如果放在室温,特别是炎热的夏天,会出现背景着色,因此,不可存放时间太长。
6、一抗变质、质量差的多克隆抗体:注意抗体的有效期,过期的抗体要么不显色要么背景着色。用新买抗体时更好设立阳性对照和用使用过的抗体作比较。
染不上的原因有哪些?
1、多聚甲醛固定时间过长或者不够:调整固定时间
2、triton透化:triton透化程度不够,或者triton透化过度
3、BSA孵育
4、一抗(你确定你加的抗体量是足够的):使用量不够或者稀释比例过大,重新调整后再重染
5、二抗(你确定你加的抗体量是足够的):和一抗一样重新稀释或者加大使用量重新染色
6、看荧光;荧光强度有可能不足,可以重新选择标记物重新标记,进行分析
定位不对的原因有哪些?
1、细胞核干扰:细胞核位置前面的细胞质染色干扰造成,可以降低抗体浓度,孵育时间
2、细胞或者组织状态不对:细胞或者组织状态不同导致你的目的蛋白细胞定位不同,造成最后的定位不对,如果一直出现定位不对问题,建议重新培养细胞调整好状态或者重新取材,进行再次染色。
3、共定位问题解析:假设想证明某一细胞发生某种变化,换句话说就是既有某种蛋白表达,又有另一种蛋白表达,两种蛋白属于共定位,该种情况可以采用免疫双标记检测;如果两种蛋白不属于共定位,假设一种在膜上表达,一种在胞浆表达,该种情况应该不属于共定位,属于共表达,这时候实验应该重新设计去验证你的结论。
4、核定位不对:核内表达的抗原定位用免疫荧光或者免疫酶标都可以。如果定位不正确,建议封闭和打孔合为一步,即在封闭液中添加0.5% TRITON-100,37度封闭2小时,加一抗后最好4度孵育过夜(16小时)。
需要技术服务的老师请联系