神经示踪逆向跨单突触病毒RV-EnVA-△G-dsRed
产品名称: 神经示踪逆向跨单突触病毒RV-EnVA-△G-dsRed
英文名称: RV-EnVA-△G-dsRed
产品编号:
产品价格: 0
产品产地: null
品牌商标: null
更新时间: null
使用范围: null
- 联系人 :
- 地址 : 武汉市东湖高新技术开发区光谷七路128号 中科开物产业园枢密脑科学技术有限公司
- 邮编 : 430074
- 所在区域 : 湖北
- 电话 : 181****1572 点击查看
- 传真 : 点击查看
- 邮箱 : marketing@brainvta.com
狂犬病毒(RV)简介
狂犬病毒(rabies virus,RV)属于弹状病毒科(Rhabdoviridae)狂犬病毒属(Lyssavirus)。野生型RV是人畜共患的狂犬病的致病因子,在神经系统中具有传播属性,对人和动物均具有较高致病性。随着反向遗传学手段的成熟,经过改造的RV,可用于神经回路研究。RV感染中枢系统后,主要标记神经元,几乎不标记胶质细胞;被感染的神经元在一定时间内(7-12天)几乎不发生明显病变及裂解。Wickersham 等基于RV疫苗株Sad B-19感染性克隆构建的复制缺陷型重组RV具有较低的毒性和较高的安全性,可清晰的标记神经元的精细形态,并通过反向互补策略实现了对神经网络联接的逆向跨单级突触追踪。
RV逆行及跨单突触原理
RV的囊膜糖蛋白(glycoprotein,G)是其逆行跨突触所必需的蛋白,其受体大量分布在轴突末端,感染后可沿轴突逆行进入神经元胞体开启病毒复制,G蛋白缺失的RV(RV-ΔG)会丧失跨突触能力,而其复制及转录不受影响(可持续高丰度表达外源基因),因此,RV-ΔG携带报告基因后,其功能类似CTB,retrobeads等,可逆向高亮度标记神经元精细形态。另外,补偿RV-G蛋白,可辅助RV-ΔG逆行跨突触感染上一级神经元,从而实现跨单突触神经网络标记。
利用重组的禽类肉瘤病毒(Aviansarcoma-leukosisvirus,ASLV)的外膜蛋白(EnvA)融合蛋白包装RV形成的病毒粒子,可特异性识别EnvA的受体TVA(TVA只存在于禽类细胞中,在哺乳动物神经元中无表达)介导病毒特异性地感染细胞。利用Cre转基因鼠结合Cre-LoxP控制表达TVA及G蛋白的AAV辅助病毒,可实现只在特定区域特异类型神经元中表达TVA及G蛋白,从而利用RV-EnvA-ΔG实现对特异类型神经元的逆向跨单级突触标记(如图1)。
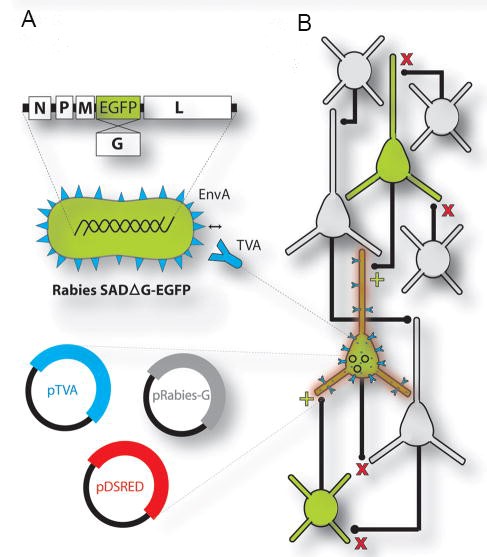
图1. A:跨单级RV改造原理; B:RV逆行跨单级突触标记示意图 (Arenkiel BR et al. Nature. 2009.)
滴度检测
病毒滴度单位为IFU/ mL(infectious units per mL),表示每毫升病毒能有效感染的靶细胞数目。病毒滴度采用梯度稀释法测定。
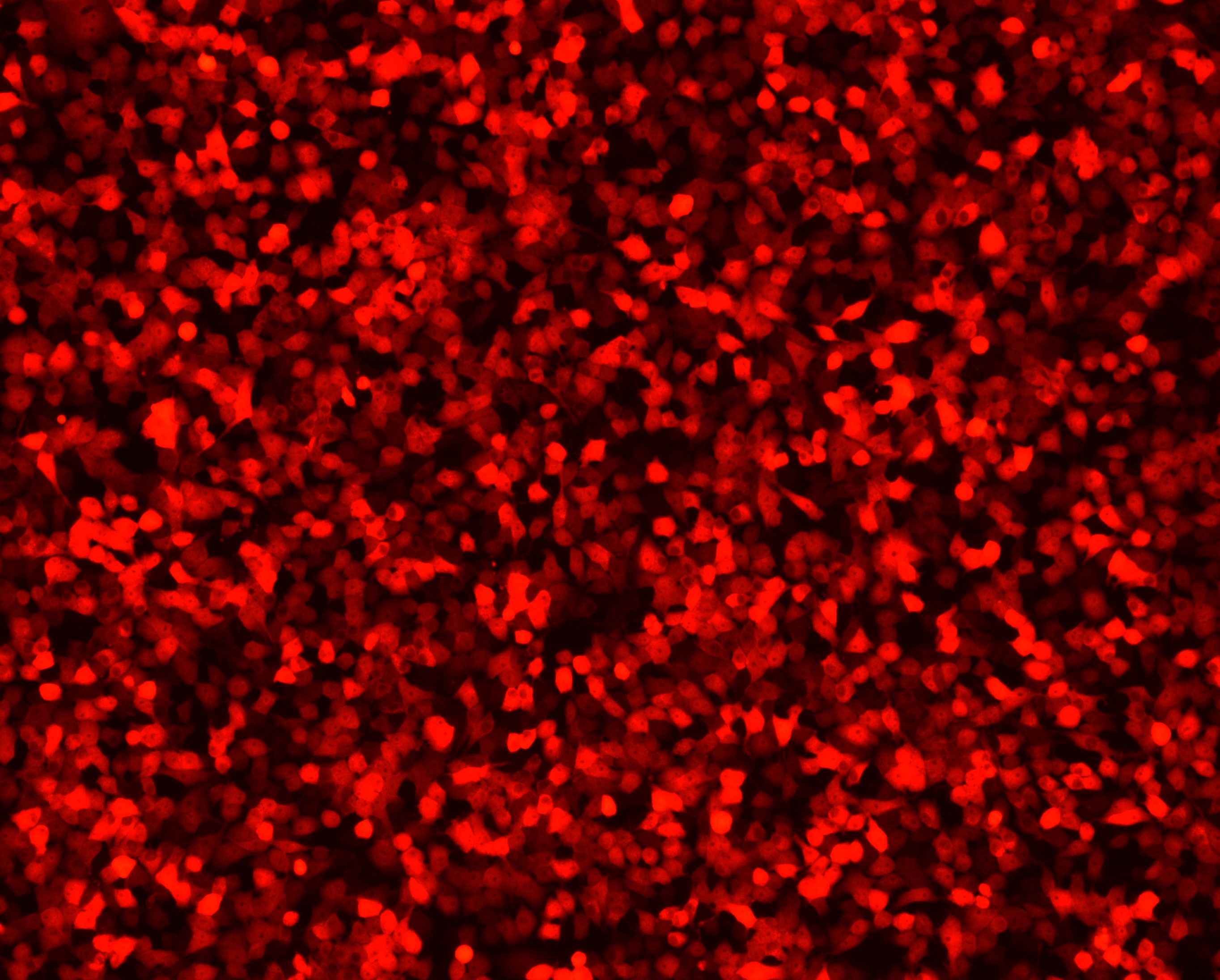
图2. RV样品制备细胞图(以RV-ΔG-dsred为例)
应用实例
适应的神经科学问题
1) 特定单个区域特异类型神经元的全脑单级输入网络标记。
2) 两个区域特异类型神经元跨单级输入网络标记。
3) 三级连接网络的跨单突触标记。
应用举例

图3. RV-EnvA-ΔG-dsRed结合AAV helper实现神经元跨单突触标记,在两侧海马、丘脑背外侧核(LD)、丘脑前背侧核(AD)、丘脑室旁核(PVA)等脑区都能看到红色荧光蛋白标记的神经元
生物安全性
利用RV示踪工具病毒进行相关神经回路标记实验,对实验员的病毒使用经验及生物安全环境有较高要求。动物实验的流程及样本取材实验必须在生物安全二级(BSL-2)实验室中完成,并符合病毒操作相关规程。
参考文献:
[1]Ian R. Wickersham, Heather A. Sullivan & H. Sebastian Seung. Axonal and subcellular labelling using modifiedrabies viral vectors.Nature communications.,Mar,2013. 3332.
[2] Benjamin F. Fosque, Yi Sun, Hod Dana, et al. Labeling of active neural circuits in vivo with designedcalcium integrators. NEURAL CIRCUITS. FEBRUARY 2015. VOL 347 ISSUE 6223.
[3] Ian R. Wickersham1,3 and Heather A. Sullivan. Rabies Viral Vectors for Monosynaptic Tracing and TargetedTransgene Expression in Neurons. CSHprotocol. June ,2015.375-385.
[4] Shinya Ohara, Sho Sato, Kei Oyama, et al. Rabies Virus Vector Transgene Expression Level and Cytotoxicity Improvement Induced by Deletion of Glycoprotein Gene. PLOS ONE.November 2013. Issue 11 ,e80245.
版权声明:
枢密科技拥有以上文字及图片内容,仅供学术机构做学术交流所用,如发现被其他公司模仿和抄袭并做商业宣传,本公司保留司法诉讼和索赔的权利。
