
荧光标记指将荧光物质共价结合或物理吸附在所要研究分子的某个基团上,具有无放射物污染、操作简便、容易观察等优点,可借助荧光特性对被标记对象进行定性、定位以及定量分析。荧光标记在蛋白质、核酸、细胞检测及免疫分析等方面显现出巨大潜能。

表 1. 常见的用于蛋白偶联反应基团。
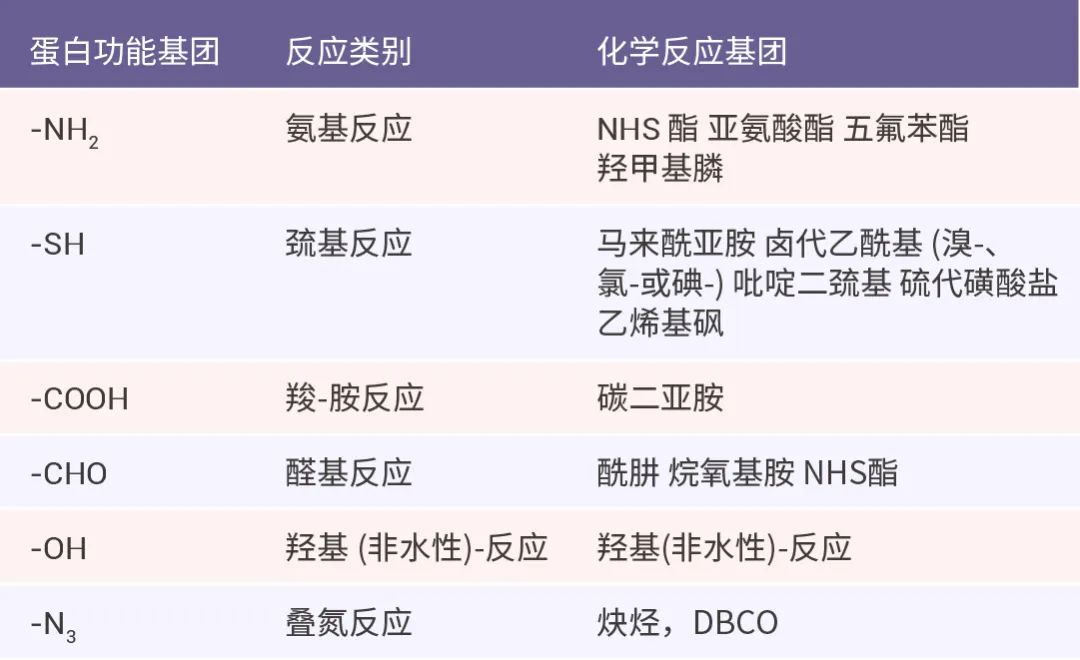
反应很多,本篇只讲 NH2 和 SH 反应 ,在文章末尾小 M 会告诉大家基本的原理!在这里我们先来到大家最关注的环节:如何标记蛋白?以及使用过程中有哪些注意事项?
染料标记蛋白,主要包含以下步骤:
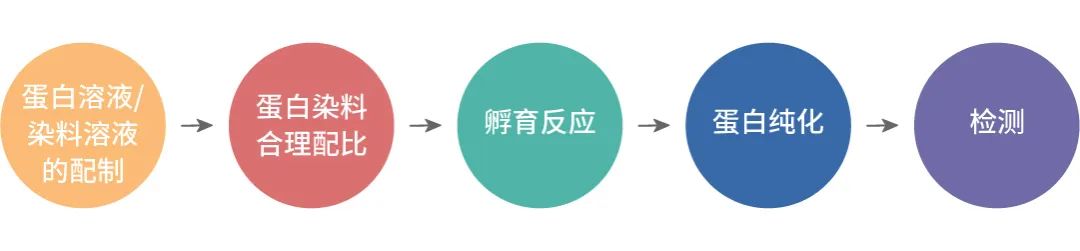

蛋白标记时蛋白溶液的配制,以下几点十分重要!
-
关于溶解:溶解蛋白时,要根据推荐的溶剂进行溶解,避免使用含伯胺 (例如 Tris,Glycine) 或铵离子的缓冲液,它们与待标记蛋白会发生竞争反应降低标记效率。低浓度的叠氮化钠 (≤3 mM 或 0.02%) 或 Thimerosal (≤0.02 mM 或 0.01%) 不会显著干扰蛋白标记,但是 20-50% 的甘油会降低标记效率。
-
标记蛋白浓度:蛋白浓度过低会大大影响标记效率,一般浓度不小于 0.5 mg/mL。若蛋白浓度过低,可用超滤管浓缩蛋白。
注意事项:蛋白必须在不含伯胺和铵离子的缓冲液中,这些基团会和蛋白争夺结合位点,会影响标记效率。

蛋白溶液配好了,我们现在开始配染料溶液,使用无水 DMSO 配制染料溶液 (多为 10 mM ),染料在 DMSO 稳定性较好,剩余染料溶液可在 - 20℃ 分装保存 1 个月。如果是水溶解,染料有易被水解的性质,建议现配现用。

我们在标记时,首要注意的是染料和蛋白的配比问题,染料过少,反应不完全,标记量太少,染料过多,则不易纯化。通常,我们推荐染料与蛋白的摩尔比在 5:1-20:1。
 案例:
案例:
此处我们以 CY3 为例,假如所需标记蛋白为 500 μL 2 mg/mL 的 IgG (MW=150,000),用 100 µL DMSO 溶解一管 1 mg CY3 染料,则所需 CY3 体积为 3.95 μL,详细计算流程如下:
1)mmol(IgG)=mg/mL(IgG)×mL(IgG)/MW(IgG): 2 mg/mL×0.5 mL/ 150,000 mg/mmol= 6.7×10-6 mmol
2)mmol(CY3)=mmol(IgG)×10: 6.7×10-6 mmol×10=6.7×10-5 mmol
3)µL(CY3)=mmol(CY3)×MW(CY3)/mg/µL(CY3): 6.7×10-5 mmol× 590.15 mg/mmol/0.01 mg/µL =3.95 µL
了解配比后,我们开始孵育,一般将染料和蛋白一起室温孵育 2 h 即可完成结合!
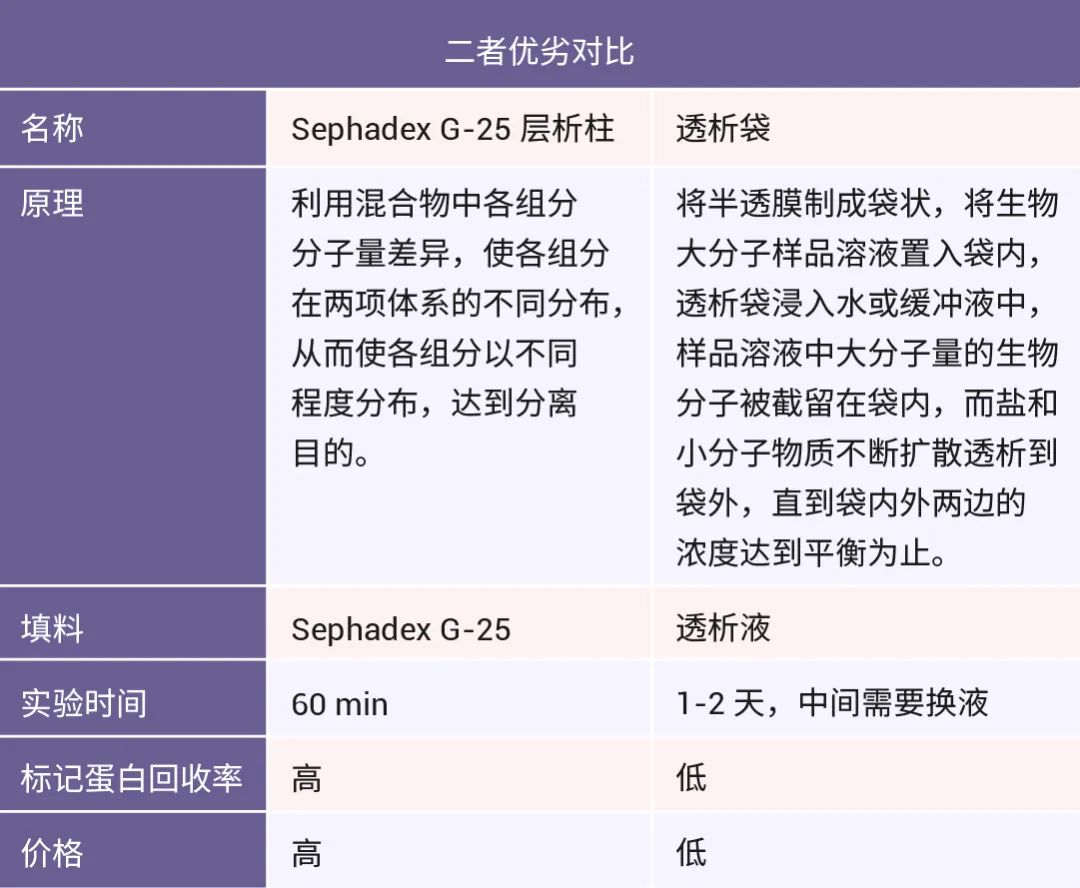
荧光标记结束后,我们需要纯化蛋白去掉多余未结合染料防止其对实验的干扰,常用的纯化工具为亲和层析柱和透析袋。
表 2. 层析柱和透析袋的对比。

忙忙碌碌终于大功告成,那么如何检测我们是否标记成功呢,通常是以下几种:
-
直接肉眼观察,根据上面的纯化原理可以得知,如果得到的产物有颜色。我们默认标记成功;
-
荧光显微镜观察,通过荧光显微镜在对应通道进行拍摄,如果观察到特定形态荧光信号即为标记蛋白;
-
蛋白电泳实验,标记后蛋白本身分子量会增大,蛋白存在微小向上拖带可以证明标记成功(如果向下大范围拖带可能是蛋白发生降解)。
-
使用分光光度计测定 F(荧光素)和 P(抗体蛋白)的比值(F/P),F/P 的比值反映荧光蛋白的特异性染色质量,一般要求 F/P 的克分子比值为1~3。过高时,非特异性染色增强;过低时,荧光很弱,标记效率低。
MCE 标记染料 Vari Fluor 系列,很好的满足您的各种标记需要!!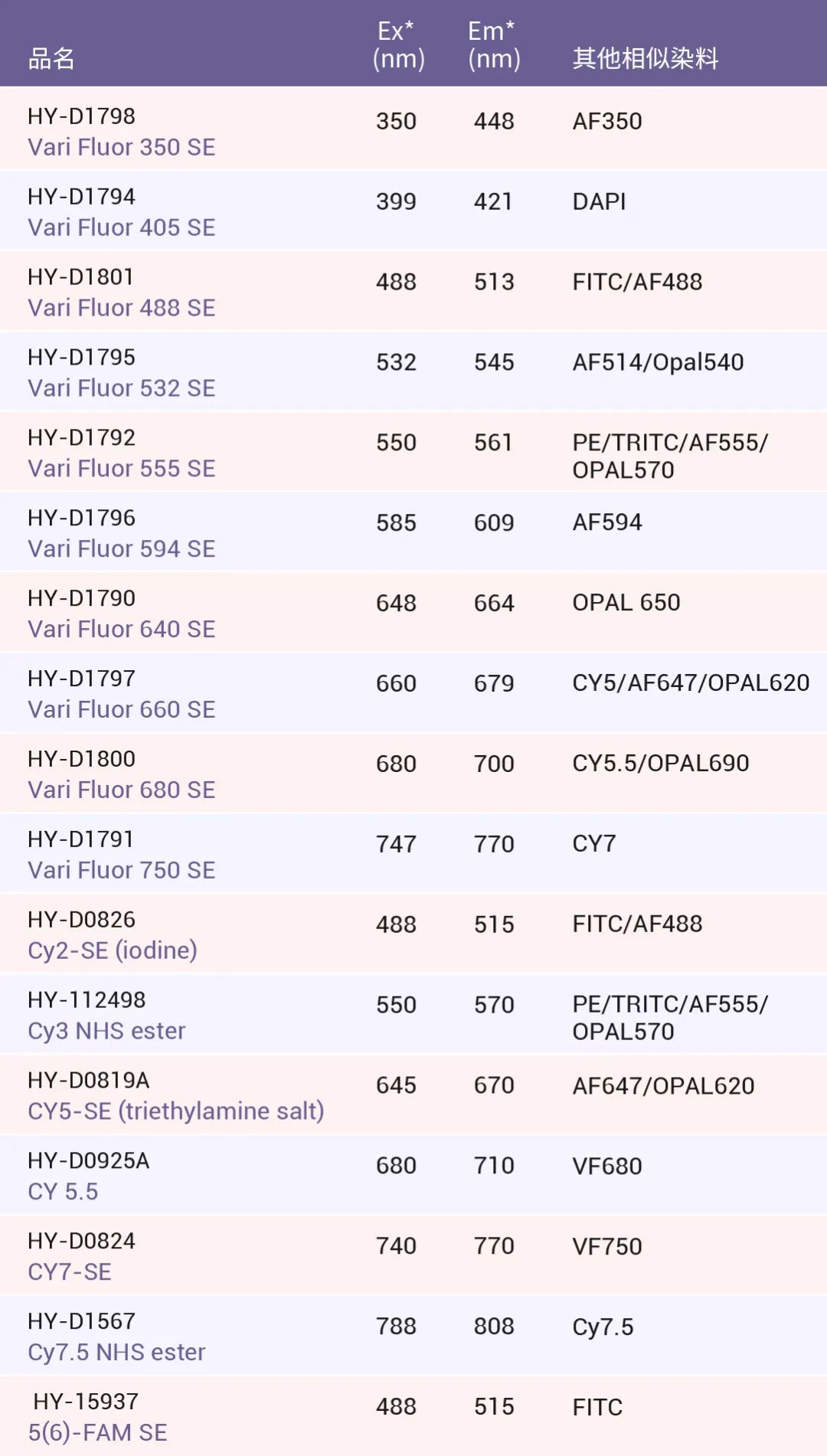

下面是原理解答时间!
- 关于蛋白氨基反应
伯胺 (-NH2) 存在于每条多肽链的 N-末端 (称为 α-氨基) 以及赖氨酸残基的侧链中(称为 ε-氨基)。由于伯胺在生理条件下带正电荷,因此它通常朝外,使得其更易于偶联而不会使蛋白质结构改变。从我们的表中可以看出,许多反应基团均可以和伯胺基结合,而在荧光标记中,最常用的是还是 NHS 活化酯 (SE)[1]。
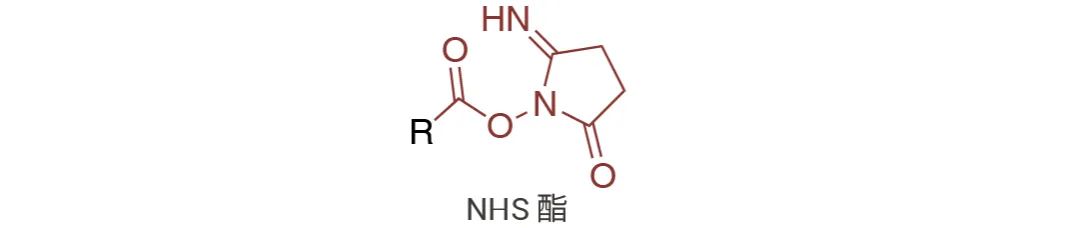
图 1. NHS 酯图示。
NHS 活化酯 (SE)
NHS,全称为 N -羟基琥珀酰亚胺酯,是 EDC (碳二亚胺) 活化羧酸分子形成的反应基团。带有活化的 NHS 酯的交联剂 和标记化合物在弱碱性条件下与伯胺反应, 产生稳定的酰胺键 (图 3)。该反应释放 N-羟 基琥珀酰亚胺 (NHS),可通过透析或脱盐轻易去除[2]。
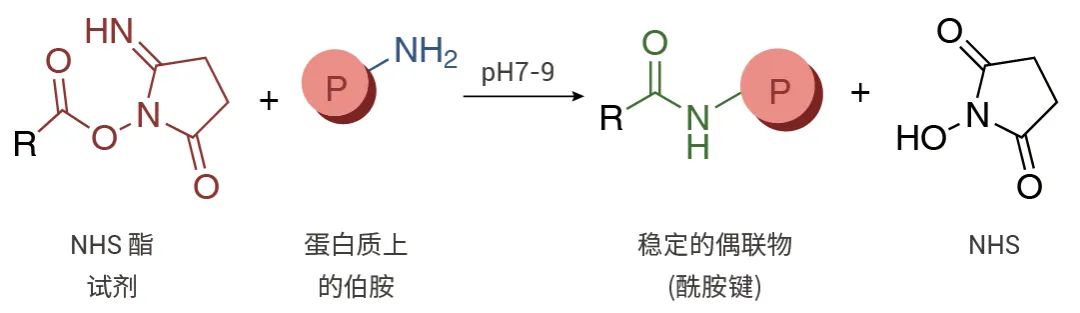
- 关于蛋白巯基反应
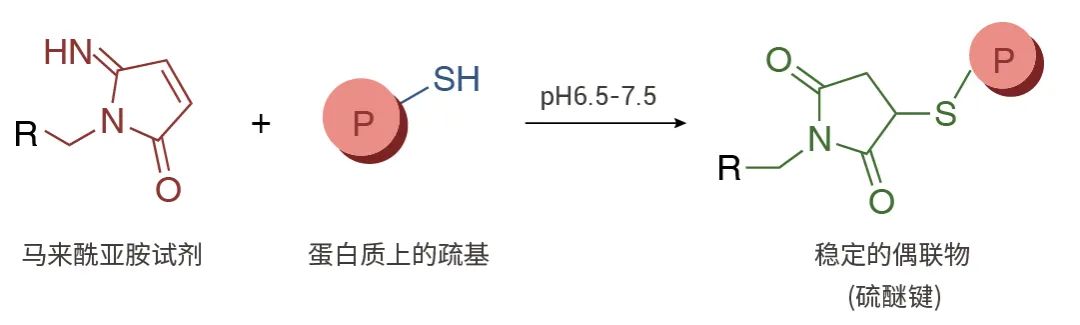
巯基 (-SH) 存在于半胱氨酸的侧链中。在进行交联反应时,必须将其还原成巯基,使其可以与大多数类型的反应基团进行交联。巯基对马来酰亚胺、卤代乙酰基和吡啶二巯基具有反应活性,在蛋白巯基标记中,马来酰亚胺的荧光探针最为常见[3]。
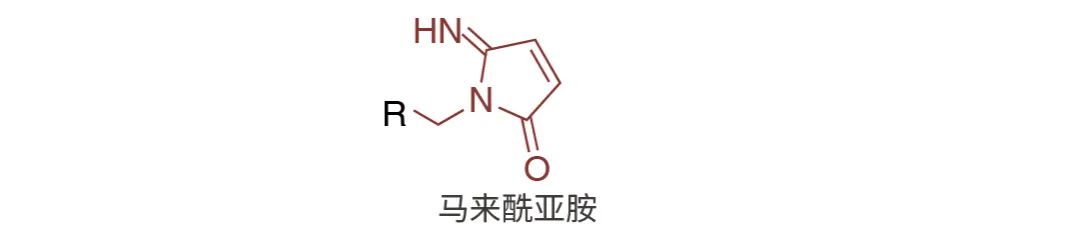
图 3. 马来酰亚胺图示。
马来酰亚胺(Maleimides)
马来酰亚胺是一种非常常用的反应活化基团,当反应混合物的 pH 值在 6.5-7.5 之间时,马来酰亚氨基团会与巯基基团特异性反应,形成不可逆的稳定硫醚键。在碱性更强的条件下(pH>8.5),支持伯胺偶联,并且还会增加马来酰亚氨基团水解成非反应性马来酰胺酸的速率。马来酰亚胺不与酪氨酸、组氨酸或蛋氨酸反应。需要注意的是,马来酰亚胺酯是一种非活化染料,使用带有马来酰亚胺酯的荧光探针时,需用 DTT 活化后方可进行后续标记[4]。

[1] Mattson G, et al. A practical approach to crosslinking. Mol Biol Rep. 1993 Apr;17(3):167-83.
[2] Grabarek Z, et al. Zero-length crosslinking procedure with the use of active esters. Anal Biochem. 1990 Feb 15;185(1):131-5.
[3] Staros JV, et al. Enhancement by N-hydroxysulfosuccinimide of water-soluble carbodiimide-mediated coupling reactions. Anal Biochem. 1986 Jul;156(1):220-2.
[4] Timkovich R. Detection of the stable addition of carbodiimide to proteins. Anal Biochem. 1977 May 1;79(1-2):135-43.
