重组腺相关病毒( Recombinant adeno-associated virus, rAAV)是一种无包膜、以单链DNA为遗传物质、基因组容量4.7kb的复制缺陷型微小病毒。rAAV具有多种血清型可亲嗜不同靶器官,免疫原性极低安全性高,2-3周可达到表达高峰且长时间稳定表达等特点,因此,rAAV广泛应用于动物研究、基础研究和基因治疗领域。

自互补AAV(Self-complementary AAV, scAAV)在rAAV的基础上将其编码区域设计成双链DNA,因此scAAV感染细胞后互补部分互补形成双链DNA,然后进行转录、翻译,不需等待第二链DNA合成,取消了rAAV基因表达的限速步骤,缩短了开始表达的时间,scAAV感染后一般3-5天即可到达表达高峰。但也正是scAAV的双链DNA结构,致使其容量缩小至2.1kb,因此外源目的基因大小需要控制在1kb左右。
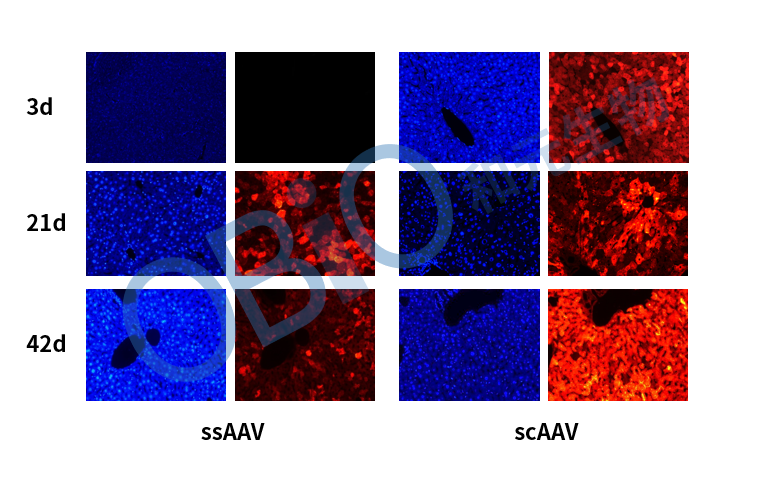
图1 ssAAV与scAAV肝脏表达(1E+11 VG/只,尾静脉注射)
自互补AAV应用领域
1. 干扰靶点筛选
短发夹RNA(Short hairpin RNA, shRNA)克隆进病毒载体感染细胞后,在细胞中表达小干扰RNA(Small interfering RNA, siRNA),抑制mRNA转录,实现抑制目的基因表达目的。对于未知的干扰靶基因的筛选一般采取体外实验的方式进行验证,在细胞系上进行验证时常会遇到体外有效果体内无效果的情况;或在原代细胞上验证,原代细胞分离难度大、培养难度高也同样制约了shRNA的靶基因效果验证;常规体内筛选靶点的方式又大大的影响了研究的速度。然而,scAAV-shRNA筛选干扰靶点可以快速并且准确地获得干扰结果,极大的加快了研究的效率。
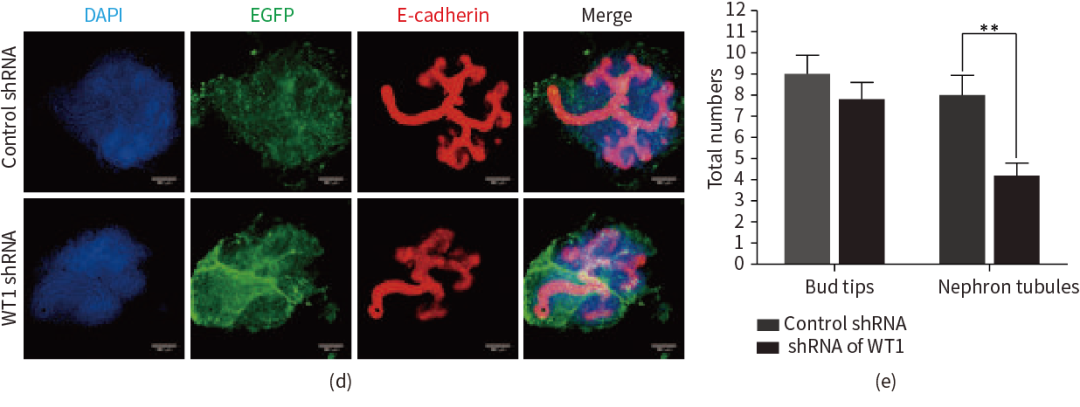
图2 scAAV2/8-WT1 shRNA抑制Wt1基因在肾脏表达
(Chen T L, et al., The Scientific World Journal, 2014)
2. 基因编辑
CRISPR/Cas9技术通过对基因水平操作实现基因敲除或基因定点编辑。利用病毒载体表达向导RNA(guide RNA, gRNA),配合Cas9小鼠/病毒,可以对小鼠的目的基因进行编辑。
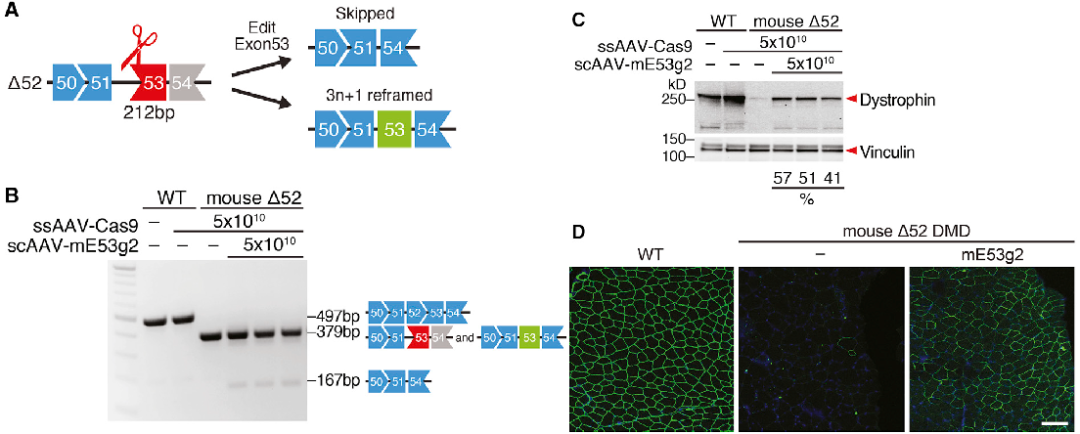
图3 肌肉注射AAV9基因编辑元件传递到D52 DMD小鼠改善营养不良蛋白表达
(Min Y L, et al., Molecular Therapy, 2020)
3. 基因敲降
Cre-LoxP重组酶体系因其特异性质,广泛应用在基因敲除(Knock out,KO)或敲入(Knock in,KI)研究中,目前常用转基因小鼠来实现。转基因小鼠由于构建周期长,价格高,繁育时间久,部分基因敲除或过表达胚胎致死等原因制约了研究的顺利进行,然而,病毒载体可以克服以上研究中出现的问题。scAAV-cre配合Flox小鼠使用,可在成年或幼年小鼠上实现快速基因敲降(Knock down, KD)。
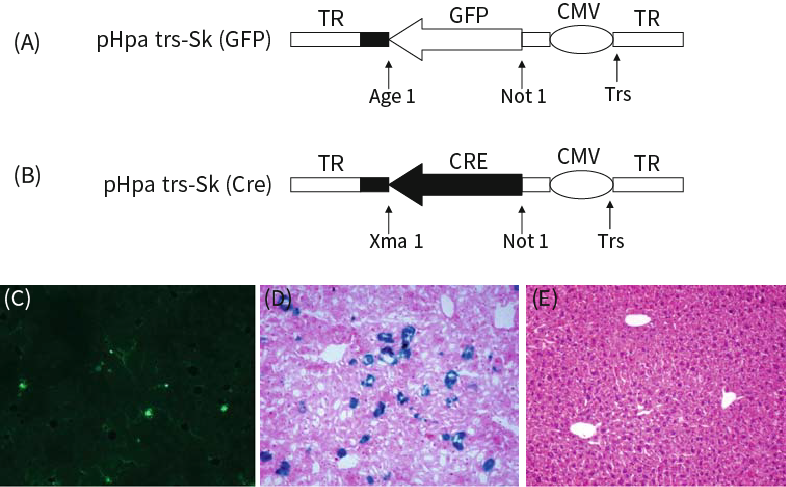
图4 scAAV-Cre在Rosa26报告小鼠肝脏中表达
(Chen S, et al., Angiogenesis, 2010)
4. 特异性标记
另外,利用Cre小鼠或scAAV-Cre配合scAAV-DIO实现更加精细、快速的细胞标记。
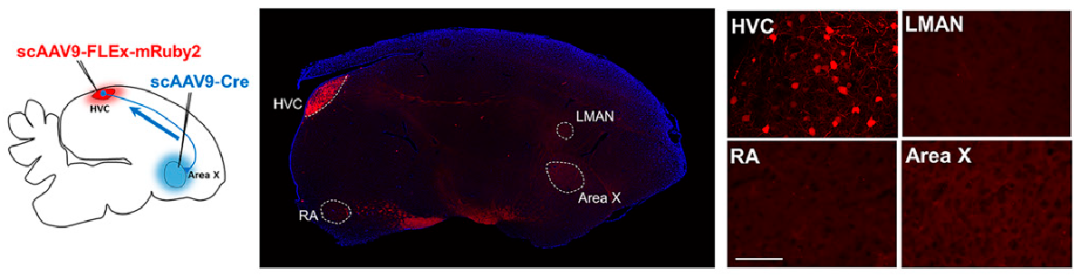
图5 scAAV-FLEx-mRuby2荧光蛋白在HVC(X)细胞群中限制性表达
(Sánchez-Valpuesta M, et al.,PNAS, 2019)
5. 过表达
利用scAAV过表达目的基因可以实现改目的基因在体内快速表达的目的,但是值得注意的是,由于scAAV容量有限,为了保证出毒及感染效率,目的基因尽量选择1kb以内。
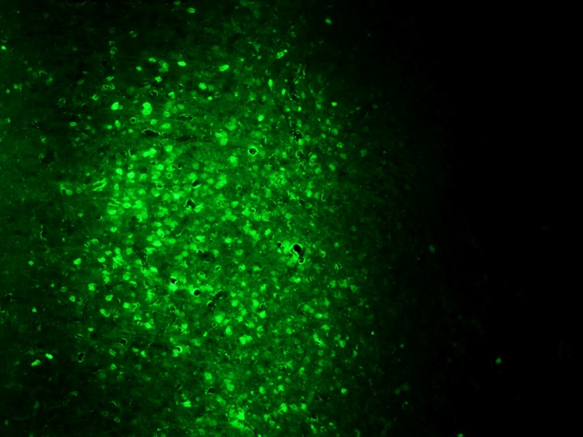
图6 scAAV9-GFP感染皮层,三天结果
小结
scAAV具有多种血清型、快速表达、稳定表达、免疫原性相对较低的特点,因此适用于多种应用场景。
