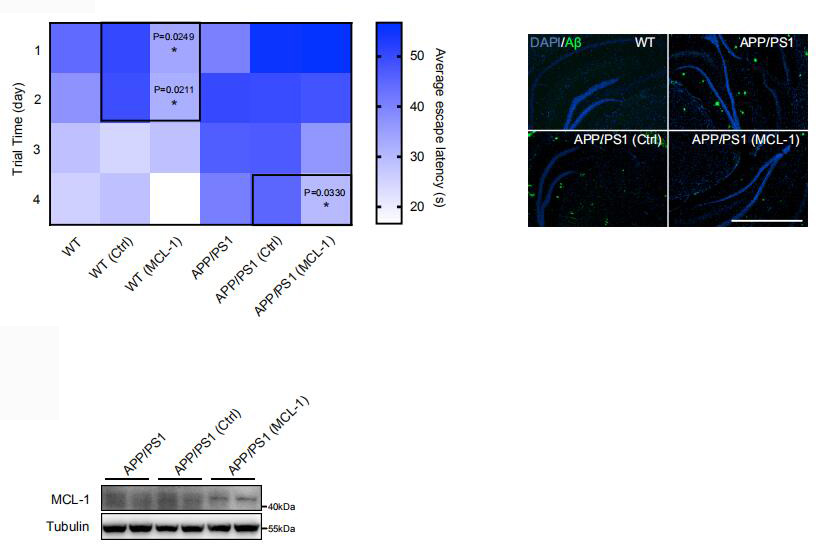
维 真 助 力 病毒产品:AAV Ctrl & AAV-MCL-1 注射动物:6月龄雄性转基因APP/PS1 (C57BL/6)小鼠 病毒用量:1.5 μL (0.15 μL/min) 注射方式:立体定位注射 注射部位:海马区 检测时间:30天后 作者以阿尔兹海默症转基因小鼠模型APP/PS1为研究对象,将AAV-MCL-1过表达载体注射至小鼠的海马区,结果显示,过表达MCL-1基因能显著改善APP/PS1小鼠的认知功能,而且海马区细胞外的Aβ斑块出现减少。此外,MCL-1的过表达也提高了野生型小鼠的学习和记忆能力,这表明MCL-1能在神经元中发挥非常重要的作用。 阿尔茨海默病(Alzheimer’s disease ,AD)是一种由神经元死亡而造成的神经变性疾病——以进行性记忆力减退和获得性知识丧失,直至日常生活活动能力完全丧失为特征,给社会和家庭带来沉重负担,成为严重的社会和医疗卫生问题。阿尔茨海默病是继心血管病、脑血管病和肿瘤之后,威胁老年人健康的重要疾病。目前,全球约有5000万人罹患阿尔兹海默症。预计到2050年,这个数字将增加至1.52 亿。当前,全球每年用于治疗、护理阿尔兹海默症病人的费用已经达到1万亿美元,而这一数字将在2030年达到目前的两倍。 阿尔茨海默病的病因复杂,目前主流观点认为是由β淀粉样蛋白(Aβ)和微管相关蛋白Tau沉积造成神经元大量死亡引发的,1998年以来,有100余种治疗此病的药物进行临床试验,但仅有6种针对此病症的药物获得FDA的批准上市,而且近年来世界各大制药公司针对Aβ或Tau蛋白开发的药物均遭到了不同程度的失败,这给人类对于AD的攻克埋上了一层巨大的阴影。 线粒体功能障碍是AD的一个基本病理特征,在散发性和家族性AD病例以及AD动物模型中,均被发现有受损的神经元线粒体的积累。功能受损的线粒体会触发能量应激,从而促进Aβ寡聚化和Tau过度磷酸化。线粒体合成调节因子PGC-1α的表达变化以及线粒体功能失调导致的钙稳态失衡都已被证实与AD的发生有关。新的研究表明,AD患者的脑细胞中线粒体自噬受到损害,能造成大量损伤性线粒体积累,导致突触功能障碍和认知功能的下降。因此,保障AD患者神经细胞中线粒体自噬的正常进行至关重要,而找到一种诱导线粒体自噬的药物靶点则是重中之重。 近期,浙江大学基础医学院夏宏光教授团队在《Nature communications 》(IF=12.121)上在线发表了一篇关于阿尔茨海默病的最新研究成果—Pharmacological targeting of MCL-1 promotes mitophagy and improves disease pathologies in an Alzheimer’s disease mouse model。该研究首次揭示了抗凋亡蛋白MCL-1作为线粒体自噬受体蛋白介导线粒体自噬的新机制,MCL-1的特异性抑制剂UMI-77可以在AD模型小鼠中显著缓解阿尔茨海默病的病理特征,改善小鼠认知;本研究提出靶向MCL-1蛋白诱导线粒体自噬是一种有巨大前景的治疗阿尔茨海默症的策略。 UMI-77作用机制示意图 点击链接阅读原文: