ESI Q-TOF质谱分析PEG化蛋白药物方法简介
贾伟
沃特世科技(上海)有限公司实验中心
PEG修饰蛋白及多肽类药物后,可在不产生毒性、不损害药效的情况下,通过增加蛋白类药物的溶解性、减少免疫原性、增加稳定性、延长体内药物半衰期等功效增强大分子药物的疗效。PEG的这种功效在1970年代后期被发现,到了1990年PEG化修饰的Adagen被美国FDA批准,至今已有若干个PEG修饰的大分子药物上市销售,这些药物在癌症、肝炎、痛风、糖尿病等疾病治疗中为患者带来了福音。
明确PEG修饰位点、确定修饰位点的数量、以及表征PEG的聚合度分布性是PEG化大分子药物运用于临床前以及药品质量监控必须且非常重要的工作。由于PEG的高分子聚合物性质,由PEG修饰后的蛋白及多肽的结构变得极为复杂。在早期对其进行质谱分析,特别是对PEG的聚合度分布性分析方面,多使用MALDI离子源类型的质谱。这是因为MALDI源离子化的样品,所带电荷数较少(单电荷离子居多),因此其质谱图相对简单;而通过ESI源离子化的样品将携带多个电荷,这使离子信号复杂,致使其质谱图谱较难解析。随着LC-ESI技术的发展, 美国Indiana大学的Lihua Huang等学者通过在色谱分析柱后加胺的技术,使样品的ESI离子化时的荷电数适当减少,从而使PEG化样品的ESI图谱得到高效的解析[1]。而MALDI TOF类质谱由于质谱分辨率的限制(目前MALDI TOF分辨率在8万内),面对分子量动辄十几万甚至更高的PEG化蛋白,其可获得的数据质量较差,因而MALDI方法可得到的PEG化蛋白的有效结构信息非常有限。
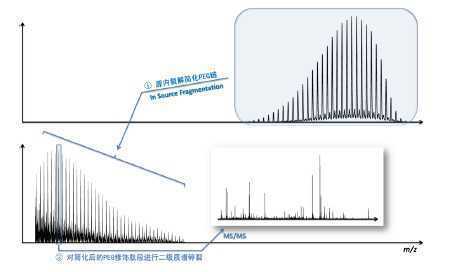
Lihua Huang等学者进一步开发了ESI Q-TOF分析P EG化蛋白的修饰位点的质谱方法[2]。这种方法包括源内裂解(ISF,In Source Fragmentation)与二级质谱(MS/MS)两个步骤。在第一步ISF过程中,PEG化多肽的PEG部分被裂解而变短;在第二步MS/MS过程中,多肽被打碎产生b、y离子碎片。通过分析携带缩短的PEG链的b、y离子信息,最终得出确切的PEG化修饰位点。ISF与MS/MS为什么可以分别 “选择”碎裂PEG化多肽的PEG与多肽两个部分呢?推测与PEG化多肽的电荷分布有关。在PEG化多肽的离子化过程中,PEG的醚键附着了大量的H+,并在ISF下完全断裂,而使冗长的P EG链缩短到一两个单位大小。之后的MS/MS过程中,由于缩短的PEG链已无H+附着不再断裂。而多肽在MS/MS中获得了碎裂的机会,并产生携带“PEG短标签”的b、y离子碎片。论文中,研究人员运用此方法成功地分析了IgG4与胰高血糖素的PEG修饰位点。
参考文献
(1) Huang L, Gough PC, Defelippis MR. Characterization of Poly(ethylene glycol) and PEGylated Products by LC/MS with Postcolumn Addition of Amines. Anal Chem. 2009, 81, 567-577.
(2) Lu X, Gough PC, DeFelippis MR, Huang L. Elucidation of PEGylation site with a combined approach of in-source fragmentation and CID MS/MS. J Am Soc Mass Spectrom. 2010, 21, 810-818
