
受自然界细菌的CRISPR系统启发,科学家们利用蛋白Cas9实现了对DNA序列的切除,极大地简化了DNA编辑过程,CRISPR-Cas9的基因组编辑技术迅速成为生命科学中最热门的技术。2017年,美国东部时间10月25日,《Science》和《Nature》两大权威杂志上先后公布了两项关于CRISPR-Cas9技术的最新研究成果,引起了科学界广泛的轰动。且CRISPR-Cas9更正了传统基因疗法的不足,能用正确序列替换“坏”基因,直接修复细胞的基因缺陷,减少了外源基因进入错误位点的可能,为很多疾病的治疗带来了新的展望。
而对于基因编辑的研究主要还停留在单基因修饰引起的下游基因表达整体变化。但是一个表型的出现往往是多个基因联合作用的结果,且一次基因编辑会引起不同的细胞产生不同的反应。那么如何来解析这复杂的基因调控网络,基因编辑联合群体单细胞转录组测序为我们解析复杂的生命现象带来了新的曙光。

10X ChromiumTM Single Cell 3'Solution作为一个高通量的单细胞测序技术,全面剖析细胞的异质性,帮助鉴定基因编辑引起不同细胞群体发生的变化。
今天小编就来给大家分享一篇《Cell》文章,带大家了解如何把混乱的基因编辑结果屡清楚。
案 例
Perturb-Seq:混合基因筛选后通过群体单细胞RNA测序解析混合分子作用环路

Perturb-Seq:Dissecting Molecular Circuits with Scalable Single-Cell RNA ProfilingofPooled Genetic Screens
期刊:《Cell》发表时间:2016.12 影响因子:28.71 发表单位:麻省理工学院和哈佛大学剑桥学院
基因筛选可以帮助推断哺乳动物细胞中的基因功能,但是仍然很难规模化分析复杂的表型,比如转录图谱。基因筛选系统分析了基因编辑对哺乳动物细胞功能的影响,但一般每次基因编辑都单独开展,目前在哺乳动物的细胞中还没有研究过几百个基因编辑同时开展对转录组整体变化的影响。然而本文通过联合CRISPR-Cas9和基于10X Genomics平台的群体单细胞转录组测序技术,准确识别目的基因,分析基因修饰对细胞状态的影响并探索这些基因如何产生相互作用和依赖。
2.1 联合CRISPR编辑和10X ChromiumTM Single Cell 3'Solution群体单细胞转录组测序技术构建Perturb-Seq;
2.2 使用Perturb-seq技术对一共200,000个BMDCs、K562细胞进行检测,评估一类转录因子对脂多糖(LPS)引起树突细胞(DC)反应的调控。
3.1 混合CRISPR筛选和单细胞转录组测序,构建Perturb-Seq技术
搭建Perturb-seq,连接了CRISPR筛选和单细胞测序,通过GBC识别干扰。首先构建编码sgRNAs的慢病毒混合物,然后去感染免疫细胞和癌细胞,构建基因干扰的细胞库,并通过标签GBC来识别sgRNA。接下来通过单细胞转录组测序来追踪细胞的增长、分化、和/或对刺激的反应。
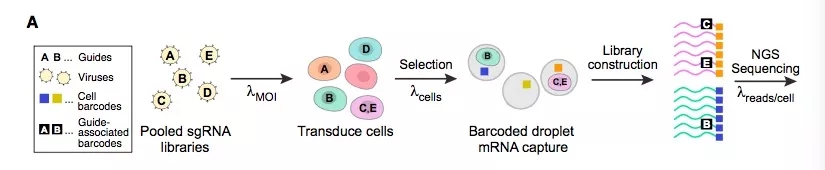
图1 Perturb-seq搭建流程示意图
3.2 构建单细胞干扰带来的转录效应的计算模型
该研究建立了MIMOSCA计算模型,其依赖于线性模型,来评估干扰对于基因表达的影响。我们用弹性正则化拟合系数矩阵,减少假设检验的次数,解决相关协变量和噪声数据。我们用置换测试来评估每个系数的重要性,通过反复修正,使得模型的干扰与细胞的表型相匹配(图2)。
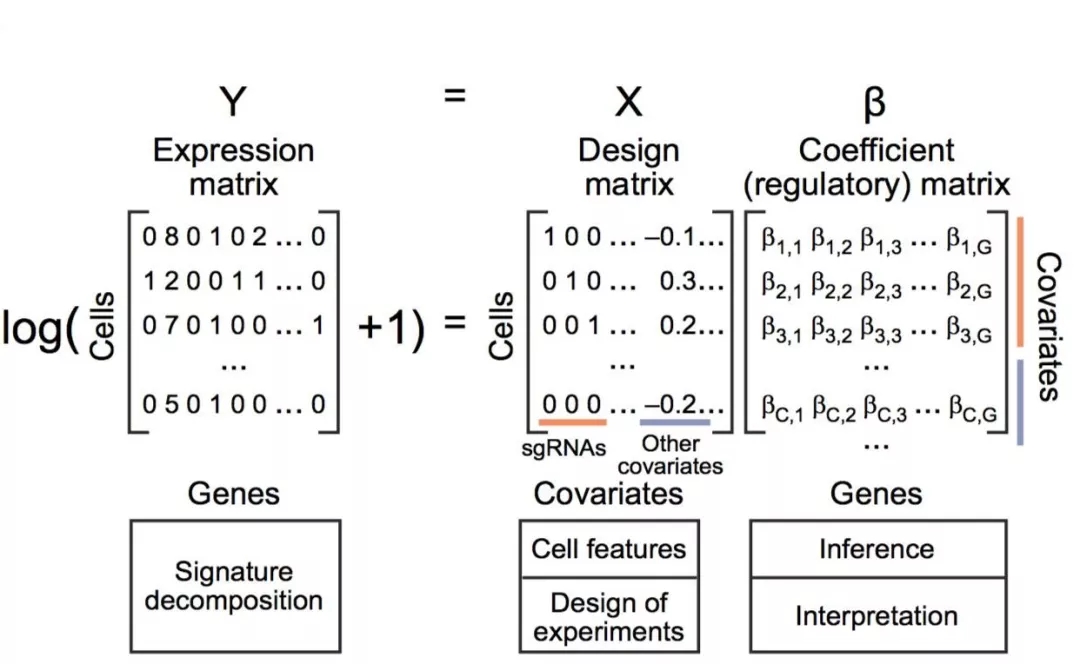
图2 MIMOSCA计算模型
3.3 通过Perturb-seq解析BMDC对LPS反应的转录程序
分析了BMDCs中24个转录因子的效应,来展示Perturb-seq如何发现正确的基因。我们培养了Cas9转基因小鼠的骨髓细胞,然后2天后感染混合了24个靶向转录因子的慢病毒。7天后使用LPS刺激细胞,收集刺激前和刺激后3小时的数据进行单细胞转录组测序分析。
接下来分析了干扰的每个转录因子对每个基因的影响,通过类似的调控作用将转录因子分配到模块中,并将基因按照如何被干扰影响分到不同的模块中。其中转录因子分为M1-M4四个模块,分别代表了其带来的不同影响,基因分为P1-P5五个模块,代表了不同的生物过程(图3)。得到分析结果也得到了Chip-seq实验的验证(图4)。

转录因子模块控制转录程序的网络图
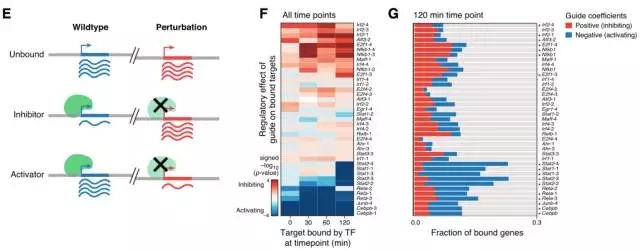
Chip-seq对Perturb-seq结果的验证
3.4 遗传相互作用影响基因表达和细胞整体状态
接下来该研究评估遗传的相互作用对于基因的影响,对于每一个被干扰的转录因子, 我们评估了靶基因的相对比例,比如他们的关系是单独附加的(无相互作用)、协同、缓存还是主导(比如两个转录因子相反的作用,但是相互作用而提高了他们中的一个)。其中大多数转录因子对(如Runx1、Irf1、Irf2或Irf4)都发挥递增作用,只有Nfkb1 (Stat1-Nfkb1, Stat3- Nfkb1,Rela-Nfkb1, Spi1-Nfkb1) 发挥缓冲作用(图5)。

图5 BMDC中转录因子的遗传互作
3.5 K562细胞的整体转录模块和特异性转录因子效应
接下来该研究对K562细胞中的10个转录因子进了Perturb-seq,在考虑细胞状态协变量的情况下拟合线性模型。
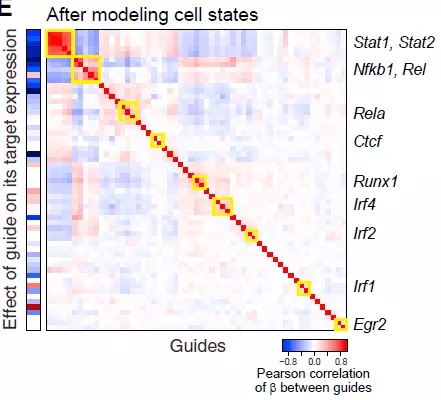
图6 K562细胞中非必需转录因子的Perturb-Seq模式图
3.6 细胞周期调控因子的干扰揭示了相似的适应性效应和有丝分裂阻滞的不同轮廓
我们针对K562细胞中的13个基因进行了干扰,这13个基因之前的研究被证实抑制了有丝分裂的过程。使用STAR方法来构建模型,所预测的结果与之前文献的报道也是一致的。
本文将CRISPR基因编辑方法,与基于10X Genomics平台的群体单细胞转录组测序方法相结合,构建了Perturb-seq,来同时分析多重遗传干扰后的转录效应。Perturb-seq降低了大量复杂扰动作用的分析时间和分析成本。
10X ChromiumTM Single Cell 3'Solution作为高通量的单细胞转录组测序技术,可以帮助我们更省时省力省钱的开展群体单细胞转录组测序的研究。作为国内第一家引进10X Genomics平台的公司,博奥晶典率先推出了10X ChromiumTM Single Cell 3'Solution平台服务,并完成了人和小鼠的肝脏、肺脏、皮肤、心脏、脑、肾脏、血液、卵巢、神经,以及鸡、斑马鱼、水稻、拟南芥、油菜、白菜等动植物的单细胞测序,拥有丰富的项目经验。
参考文献:
[1] Atray Dixitet al., Perturb-Seq:Dissecting Molecular Circuits with Scalable Single-Cell RNA ProfilingofPooled Genetic Screens (2016). Cell. IF:28.17.
博奥晶典科研服务事业部 商桂娜、王美静、李媛媛 | 文案
部分配图来源于网络 侵删
