新型冠状病毒肺炎(COVID-19)是由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)感染引起的,许多患者出现严重的呼吸系统疾病,需要住院和机械通气。虽然大多数患者康复了,但病情复杂,病死率可高达10%。目前,在世界范围内已确诊的感染人数超过3300万人,造成100余万人死亡。
人类免疫反应如何控制或加剧COVID-19目前尚不清楚,而明确疾病急性期的免疫应答有助于确定治疗方法和研制有效的疫苗。为了明确病毒感染期间免疫应答和发病机制与临床表现之间的相关性,Divij Mahew等学者对COVID-19患者、康复个体及健康个体进行了对比研究,结果发表在2020年9月的Science期刊上,题为《Deep immune profiling of COVID-19 patients reveals distinct immunotypes with therapeutic implications》。
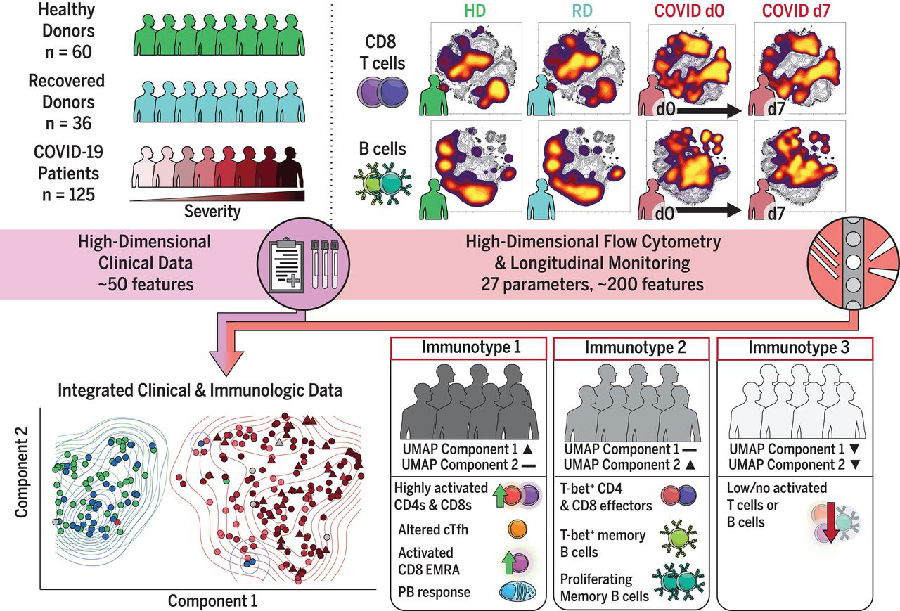
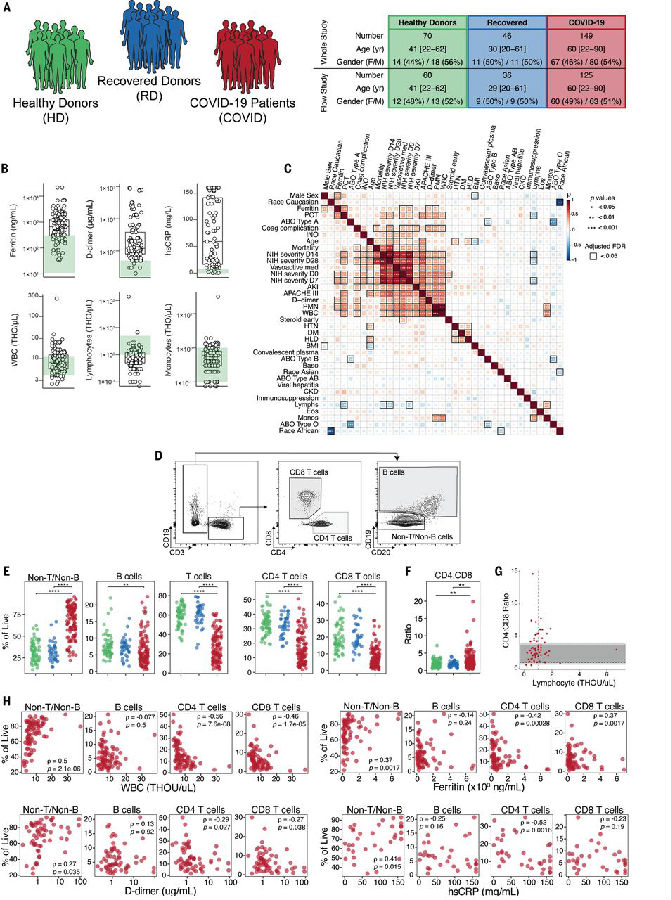
研究的对象分为三组:COVID-19患者组(149人)、康复个体组(46人)和健康个体组(70人),采集血样,综合分析约200个免疫特征参数,同时采用高维细胞计数技术对外周血单核细胞进行分析和比较。以此来分析SARS-CoV-2感染的免疫学与临床模式、疾病严重程度和进展之间的关系。
结果显示:
1. 临床特征的相关性分析显示:COVID-19不同严重程度指标与临床特征或干预措施相关,例如D-dimer、作用于血管的药物等,而白细胞和中性粒细胞等都与疾病严重程度相关的指标(APACHE III、IL6)之间存在相关性。同样,年龄、死亡率与疾病严重程度相关指标和炎症、并存病等都存在相关性。
2. 与健康组和康复组相比,COVID-19患者B细胞和CD3 T细胞的频率降低,反映临床淋巴细胞减少;而非B细胞和非T细胞的相对频率相应升高。较低的T细胞计数与临床炎症标志物有关,包括铁蛋白、D-dimer和hsCRP。因此,COVID-19患者表现出复杂的临床特征可能与淋巴细胞群改变相关。
3. 对125例住院患者进行高维细胞计数分析发现,部分患者的的CD4和CD8 T细胞被激活,而部分患者的T细胞应答则受到限制。通过检测KI67表达和CD38、HLA-DR共表达发现很多患者体内CD4和CD8 T细胞增殖和激活,与在其他感染(埃博拉病毒和登革病毒感染)中观察到的抗病毒反应一致。
4. 约2/3的患者有浆母细胞(PB)应答,且数量超过总B细胞的30%,约70%的患者产生了SARS-CoV-2特异性抗体(针对S蛋白的IgG和IgM)。然而,与对照组相比,约20%的患者T细胞活化或PB反应很少。部分患者体内的应答反应随时间而下降,这一现象与典型的抗病毒反应动力学类似;然而,在另一些患者体内强烈的T细胞和PB反应会维持稳定或随时间而增强。
5. 通过UMAP方法,研究者从检测的约200个免疫特征参数中提取出三种COVID-19免疫表型:(1)免疫型1与疾病严重程度相关,表现为CD4 T细胞高度活化,循环T滤泡辅助细胞(cTfh)缺乏,CD8“EMRAs”激活,CD8 T细胞和PBs细胞过度激活或衰竭。(2)免疫型2与疾病严重程度不相关,表现为CD4 T细胞激活较少,Tbet+效应CD4和CD8 T细胞以及增殖记忆B细胞较少。(3)免疫型3与疾病严重程度呈负相关,缺乏明显激活的T细胞和B细胞应答。
有一点需要注意的是:所有三种免疫类型的患者都有死亡病例。