
编者按
今天,我们特别关注一项于2023年发表在《Developmental Cell》的新研究——《A platform for efficient establishment and drug-response profiling of high-grade serous ovarian cancer organoids》,该研究提出了一种高级别浆液性卵巢癌(HGSC)类器官的建立和长期培养方案,使得类器官建立成功率提高53%。此外,HGSC类器官保留了原始肿瘤的基因组和表型特征,并且类器官药物反应与临床结果一致。
一、研究背景
高级别浆液性卵巢癌(HGSC)是最普遍和最致命的卵巢癌(OC)类型,占OC死亡率的70%-80%。HGSC的特点是分子异质性高,仅显示少数复发性遗传异常,如TP53功能丧失(91%-96%的患者)或BRCA1 / 2基因突变(20%)。并且在过去的几十年里,HGSC患者的生存率几乎没有改善。
目前,肿瘤细胞减灭术联合铂类和紫杉烷类药物化疗仍然是一线治疗方案,虽然初始应答良好,但大多数患者仍会复发。PARP抑制剂的引入提高了BRCA1/2突变或DNA双链断裂修复中其他缺陷患者的总生存期,可作为鉴定患者分层的预测性生物标志物,在HGSC中产生临床益处。因此,在临床前模型系统中捕获HGSC的巨大分子复杂性对于促进发现新的生物标志物和匹配的治疗策略至关重要。
患者来源的癌症类器官,作为能够自我扩增的三维细胞培养物,与标准细胞系相比,保留了遗传异质性,并更接近原始肿瘤的形态特征。与患者来源的异种移植物(PDX)相比,它们的成本更低,更易于维持和扩增。近年来,来自OC和其他实体瘤的类器官已被用于分子生物学研究和药物筛选。然而,类器官构建的成功率因肿瘤类型而异,限制了它们的广泛可用性。虽然来自许多OC类型的类器官的建立已经成功,但据报道,来自HGSC衍生的类器官培养物的成功率实际上仍然相对较低,只有23%—38%。
此外,HGSC类器官主要由新鲜的手术样本培养而成,这些样本只能在有限的时间内存活,并且需要医院和研究机构之间的地理位置接近以及昂贵的基础设施。这给HGSC类器官的建立和广泛可用性带来了重大限制。因此,需要为HGSC类器官的高效、长期培养设计培养基条件,同时也需要评估它们在基于类器官的功能测定中的相关性。
二、主要研究成果
1、建立HGSC类器官培养基
研究者使用来自肿瘤细胞减灭术、腹腔镜活检或腹水引流的癌症患者样本,研究关于HGSC类器官培养基的优化和随后的类器官培养。
本研究采用了Advanced DMEM/F12培养基,并添加了Glutamax、Primocin、N-乙酰半胱氨酸和B27添加剂(“基础培养基”)。然后,研究者评估了单个培养基添加剂对HGSC原代细胞短期类器官形成和生长的影响。添加成纤维细胞生长因子(FGF)-10,p38抑制剂SB202190或TGF-β受体抑制剂A83-01可改善类器官形成。另一方面,添加EGF、FGF-2或Noggin导致细胞附着增加和类器官形成减少。R-Spondin 1、烟酰胺(1mM)或前列腺素E未引起任何可观察到的影响。
因此,研究者继续使用基础培养基,补充有FGF-10、SB202190和A83-10(培养基0.1;M0.1)进一步优化。本研究还表示添加FGF-4可导致传代期间类器官形成增加(培养基0.2;M0.2)。在随后的实验中,用β-雌二醇补充M 0.2增加了HGSC类器官的形成和生长(培养基0.3;M0.3)。烟酰胺的添加进一步改善了类器官的形成(培养基1;M1)。
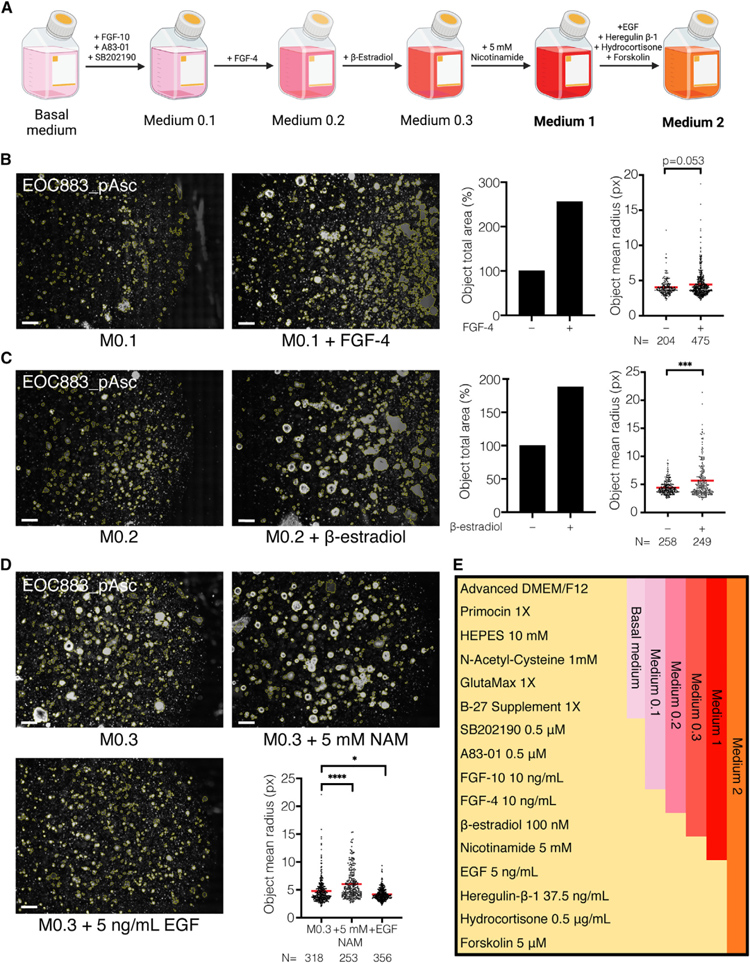
原文图1. HGSC类器官培养基配方的建立
2、两种培养基配方提高HGSC类器官培养的成功率
有趣的是,当M0.3补充EGF时,研究者观察到EOC883 _ pAsc 样本的生长显著降低并最终导致培养物死亡。与之相反,EGF促进了其他几个样本的生长。将表皮生长因子与其他添加剂(包括Heregulin β-1、氢化可的松和Forskolin)结合,进一步改善了这些样本的生长和扩增。而EOC883_ pAsc生长和类器官形成受到这些添加剂的损害。
这些实验表明,EGF、Heregulin β-1、氢化可的松和Forskolin的加入可以促进或限制类器官的生长,而这取决于样品。因此,为了最大限度地提高类器官生长成功的可能性,每个 HGSC样品应该在两种不同的培养基中平行培养即M1和培养基2(M2; 补充有Heregulin β-1,氢化可的松和Forskolin)。
该研究通过在M1,M2和以前发表的HGSC类器官培养基中平行培养三个HGSC样本来测试。正如预期的那样,EOC883 _ pAsc只能在M1中成功培养。在其他配方中,生长受到抑制,甚至死亡。相反,EOC382 _ pOme可以在M2和其他HGSC类器官培养基中培养。
值得注意的是,在两种含EGF浓度高于M2的两种培养基中,类器官的生长加速,表明 EOC382 _ pOme 受益于富含生长因子的培养条件。最后,EOC136 _ pAsc 未能在任何测试的培养基配方中稳定传代,但在M2中观察到最大程度的短期生长。综上所述,这些结果表明,在M1和M2中平行培养HGSC原代细胞能够成功地从样品中构建类器官,否则如果使用以前发表的方法培养则会失败。
Maenhoudt等在22例患者中成功培养了5例不同的HGSC患者(作者定义为> 4次传代)的类器官,总体成功率为23%。Hoffmann等成功将45例患者中的13例培养成类器官(> 6次传代),成功率为29%。Kopper等报告了成功构建的类器官,这些类器官未显示出生长停滞,并且在29例尝试的患者中,有11例患者至少达到第8次传代。
研究者使用了更严格的标准,并在满足四个条件的情况下定义为成功的类器官培养:(1)设法将细胞培养至少10代;(2)没有观察到样品生长停滞;(3)扩增样本中的癌细胞;(4)培养的细胞携带与原始样本相同的TP53突变。总体而言,研究者尝试从19名不同患者的癌症样本中培养类器官。使用 M1/M2 方法,对10名患者进行了类器官培养,成功率为 53%。
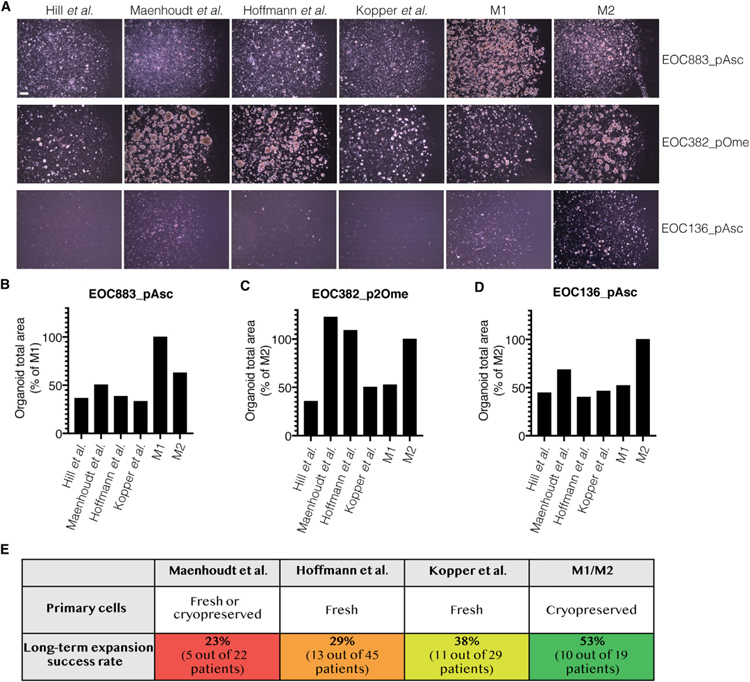
原文图2. M1/M2方法提高了HGSC类器官培养成功率
3、建立可扩展的长期HGSC类器官收集系统
本研究总共构建了17例稳定的长期HGSC类器官——M1培养了7种,M2培养了10种。此外,研究者从不同临床阶段采样的患者中获得类器官: 化疗治疗前(n = 8),化疗期间(n = 4)和复发期间(n = 5)。并根据国际妇产科联合会(FIGO)分期诊断抽样患者IIIC (n = 4),IVA (n = 5)和IVB(n = 1)。
随后,根据WGS数据,研究者估计了类器官和原始样本的癌细胞含量。类器官的特点是肿瘤纯度高(99.2%±1.1%),与它们来源的原始样本肿瘤纯度(44.1%±29%)相反。HGSC类器官在培养中于患者间和患者内水平均表现出广泛的形态异质性。例如,EOC677 _ pAsc类器官生长为小的密集聚集体,而 EOC677 _ rAsc和 EOC677 _ r2Asc形成松散聚集的囊状结构。其他观察到的结构包括球状聚集体(例如,EOC172 _ rAsc或EOC733 _ iOme)或大的、不规则的、密集的聚集体(例如,EOC733 _ pPer,EOC1120 _ pOme或EOC1120 _ rAsc)。为了比较类器官与相应患者样本的表型,研究者进行了苏木精和伊红(H & E)和IHC染色。
总的来说,类器官表现出与肿瘤相匹配的上皮细胞的形态特征,包括腺乳头生长模式和严重的(3 +)核多形性。
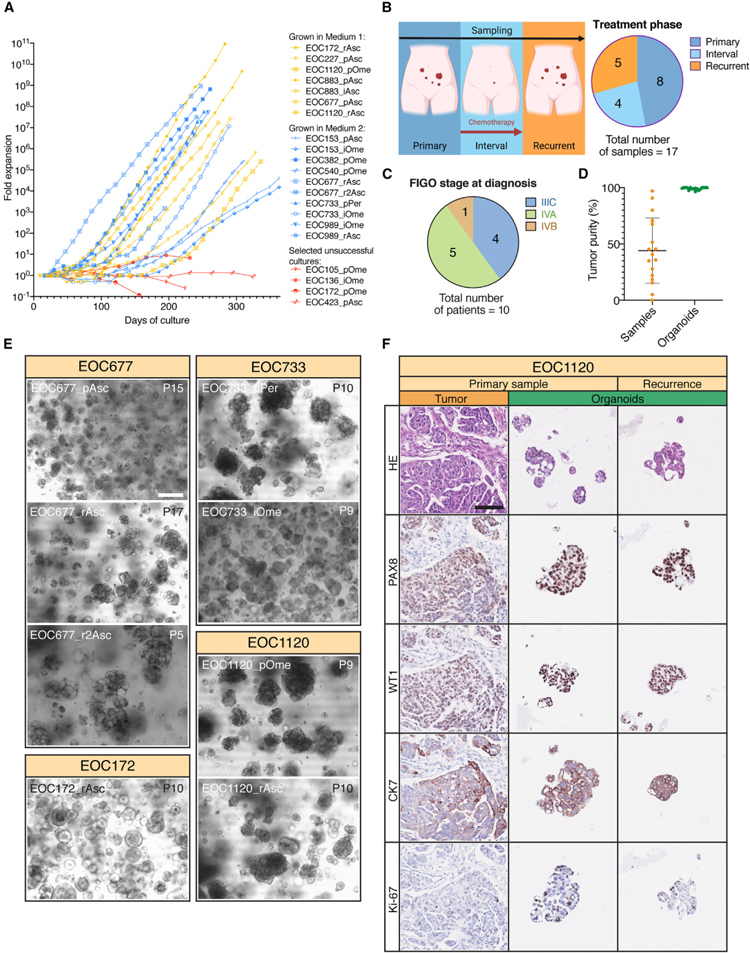
原文图3. HGSC 类器官集合概述
4、长期培养的HGSC 类器官保留患者样本的基因组图谱
研究者进行了WGS分析,以研究类器官是否重现了原始肿瘤的基因组图谱。所有类器官模型都含有与在相应肿瘤组织中观察到的相匹配的TP53突变。值得注意的是,TP53突变的变异等位基因频率(VAF)在所有类器官培养中均为1,证实类器官仅包含癌细胞。HGSC的其他遗传畸变特征包括在RB1,CSMD3,CDK12,KMT2B,KMT2C 和CCNA2中,CCNE1,KRAS,MYC和MECOM的扩增和点突变。
一般来说,在原始肿瘤样本和类器官之间以及在长期传代过程中,这些细胞是保守的。使用来自同一患者的不同临床过程阶段的样品使研究者能够获得代表肿瘤遗传进化的类器官。然而,在一些类器官培养物中,观察到在晚期传代时出现的新突变,这表明在培养过程中发生遗传进化或克隆选择。总的来说,类器官与原始患者样本表现出非常高的突变一致性。此外,研究者将特定突变过程相关的突变特征与肿瘤样本和匹配类器官的突变特征相匹配,发现单碱基替代特征3(SBS3)和小插入和缺失特征6(ID6)在17个患者样本中的12个中被鉴定出来。值得注意的是,类器官还重现了临床进展期间SBS3和ID6特征的出现(例如,在患者EOC989中复发时出现的 SBS3特征)。
为了比较类器官和与其匹配的肿瘤的基因组图谱,研究者进行了拷贝数变异(CNV)分析。类器官在长期传代过程中维持了原始肿瘤的CNV谱。此外,来自同一患者的不同临床过程阶段的类器官维持了在肿瘤进化过程中获得的基因组变化(例如,在患者EOC677的第一次复发时获得染色体7片段)。总的来说,目前的类器官收集重现了病人间的基因组异质性,并准确地反映了疾病的演变。
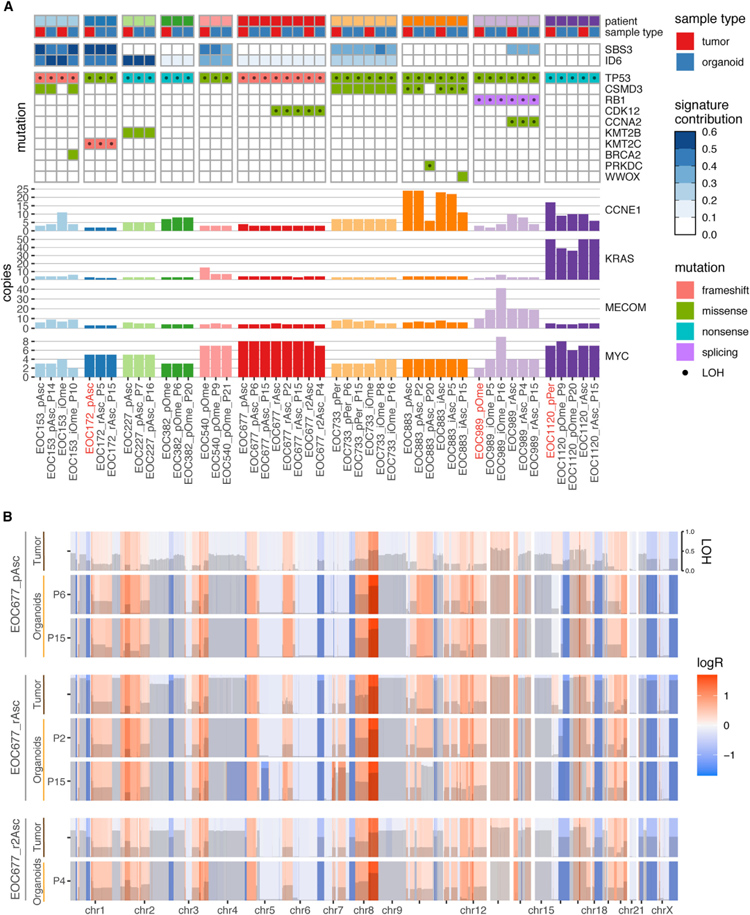
原文图4. 用M1/M2培养的HGSC类器官在长期培养中维持了原始肿瘤组织的基因组图谱
5、HGSC类器官维持了肿瘤的转录组学特征
本研究对5名患者的7个类器官样品和它们来源的肿瘤/腹水材料以及患者EOC883的肿瘤样品进行了scRNA-seq。
研究者对总共30,492个细胞进行了聚集,得到了26个子群。来自类器官样本的细胞形成类器官特异性簇,而来自患者样本的细胞形成多个混合簇。标记物表达分析显示,混合簇由基质细胞或免疫细胞组成,患者特异性簇由癌细胞形成。然后研究者探讨了在肿瘤样本中被鉴定为患者特异性标志物的基因的表达是否反映在相应的类器官中。他们观察到 EOC677,EOC540和 EOC883患者的肿瘤样品和类器官具有非常强的相关性。对于患者,EOC733和EOC382类器官和肿瘤特异性标志物的相关性略小。
接下来,他们研究了HGSC类器官是否代表原始患者样本在细胞亚群水平。为此,研究者使用CNV推断单细胞中基因组拷贝数变异变化,并识别群体中类似改变的细胞的亚簇。研究者分析了每位患者的肿瘤样本和类器官单细胞谱,并确定了3-5个主要的遗传亚群。对于患者 EOC677,所有的3个亚簇都包含来自4个分析样本(原发性和复发性腹水以及腹水来源的类器官)的细胞。
综上所述,这些数据表明,类器官在单细胞水平上与原始肿瘤样本高度相似。
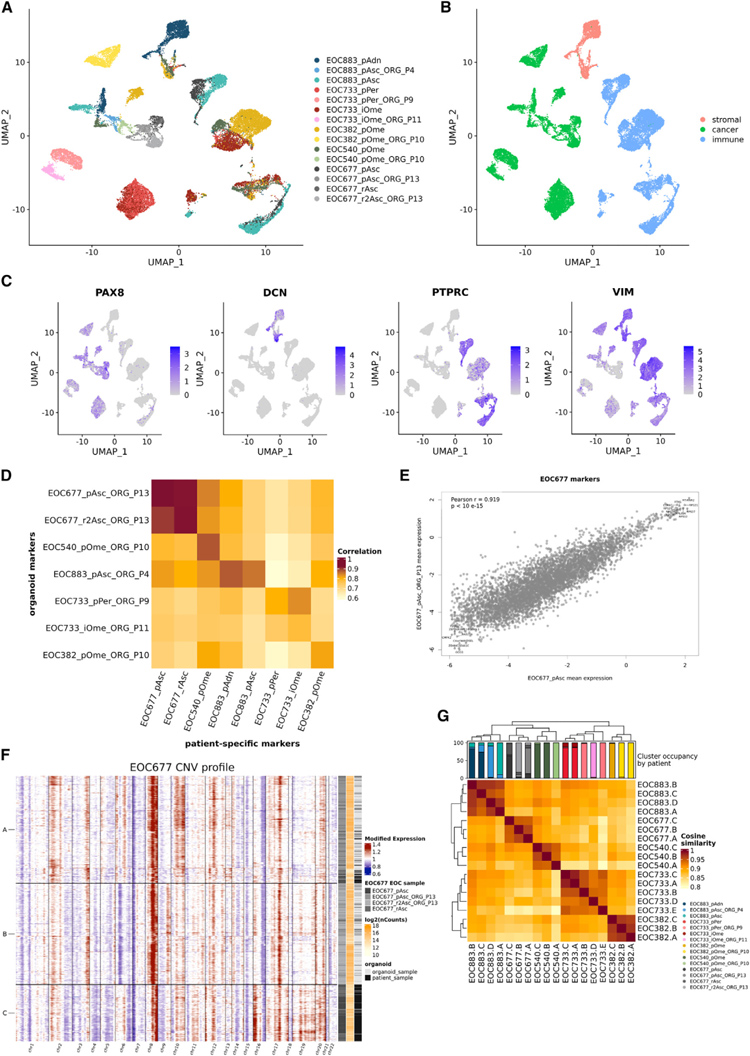
原文图5. HGSC 类器官保留了原始肿瘤的转录组学特征
6、HGSC类器官药物反应与患者临床结果的相关性取决于培养基
最后,研究者对11种类器官培养物进行了药物反应分析,以研究类器官药物反应是否与先前在患者中观察到的药物反应相关。为此,研究者将悬浮在基底膜提取物中的类器官片段接种到超低附着的384孔微孔板中,并用适合样品生长的培养基覆盖培养物。
研究者将生长培养基和人血浆样培养基(HPLM)中的类器官暴露于HGSC临床治疗中使用的一组药物(化疗药物:卡铂、紫杉醇、卡铂/紫杉醇组合和吉西他滨;PARP抑制剂:奥拉帕尼、尼拉帕尼和鲁卡帕尼)和Wee1抑制剂adavosertib。实验表明类器官培养物对吉西他滨、PARP 抑制剂和 adavosertib的敏感性在M1/M2和HPLM中相似。
然而,生长培养基和HPLM培养的类器官培养物对一线化疗药物卡铂、紫杉醇及其组合的反应通常不同。然后,研究者探讨了体外药物反应是否与临床相应患者记录的药物反应相匹配。例如,患者EOC677对卡铂/紫杉醇联合用药表现出临床反应,表现为CA125血液水平降低(从1,593 a.u.降至11 a.u.),随后稳定在正常范围内(<35 a.u.)。
与生长培养基相比,这与HPLM中的类器官药物反应更接近。复发时,患者接受剂量密集型紫杉醇治疗,诱导瞬时反应,然后对治疗产生耐药性,这与生长培养基和HPLM中的EOC677_rAsc对紫杉醇的部分耐药性相匹配。随后用吉西他滨治疗诱导CA125更持久的正常化和完全放射学反应,这与两种培养基中类器官(特别是 EOC677_pAsc和EOC677_rAsc)的敏感性相对应。
综上所述,这些结果强调了仔细考虑实验培养基条件的重要性,以便尝试将基于类器官的功能测定结果与临床结果相关联。
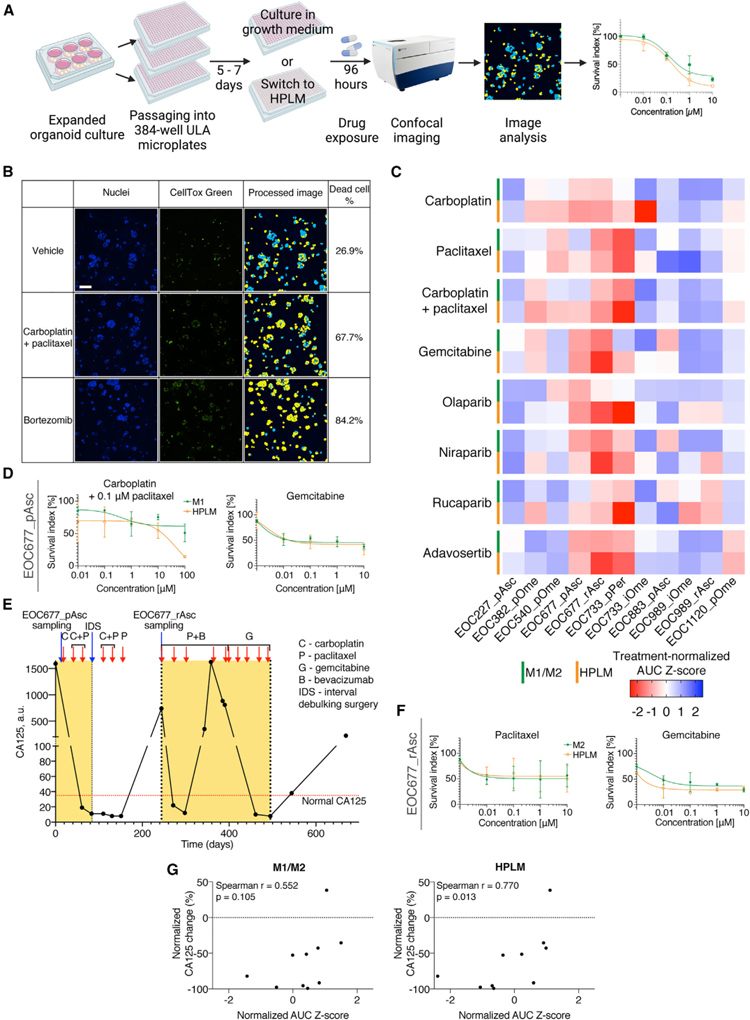
原文图6. HGSC类器官药物反应与临床结果的相关性取决于培养基
三、编者点评
本研究提出了一种高效的HGSC类器官衍生和长期培养的方法,并对这些模型进行了全面验证,证明它们保留了患者特定的遗传和表型特征。本研究还强调需要进一步评估培养条件,以促进HGSC类器官在癌症研究中的广泛应用及其在个性化癌症医学中的相关性。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展科研服务CRO、智慧实验室建设和精准医疗三大业务。目前,环特类器官平台已成功搭建多种肿瘤及正常类器官的培养平台,已有多种肿瘤类器官培养试剂盒和试剂在售,欢迎有需要的读者垂询!
参考文献
[1] Bowtell D.D., Böhm S., Ahmed A.A., Aspuria P.J., Bast R.C., Beral V., Berek J.S., Birrer M.J., Blagden S., Bookman M.A., et al. Rethinking ovarian cancer II: reducing mortality from high-grade serous ovarian cancer. Nat. Rev. Cancer. 2015;15:668–679. doi: 10.1038/nrc4019.
[2] Cancer Genome Atlas Research Network Integrated genomic analyses of ovarian carcinoma. Nature. 2011;474:609–615. doi: 10.1038/nature10166.
[3] Ciriello G., Miller M.L., Aksoy B.A., Senbabaoglu Y., Schultz N., Sander C. Emerging landscape of oncogenic signatures across human cancers. Nat. Genet. 2013;45:1127–1133. doi: 10.1038/ng.2762.
[4] Poveda A., Floquet A., Ledermann J.A., Asher R., Penson R.T., Oza A.M., Korach J., Huzarski T., Pignata S., Friedlander M., et al. Olaparib tablets as maintenance therapy in patients with platinum-sensitive relapsed ovarian cancer and a BRCA1/2 mutation (SOLO2/ENGOT-Ov21): a final analysis of a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol. 2021;22:620–631. doi: 10.1016/S1470-2045(21)00073-5.
[5] Macintyre G., Goranova T.E., De Silva D., Ennis D., Piskorz A.M., Eldridge M., Sie D., Lewsley L.A., Hanif A., Wilson C., et al. Copy number signatures and mutational processes in ovarian carcinoma. Nat. Genet. 2018;50:1262–1270. doi: 10.1038/s41588-018-0179-8.
[6] Semertzidou A., Brosens J.J., McNeish I., Kyrgiou M. Organoid models in gynaecological oncology research. Cancer Treat. Rev. 2020;90:102103. doi: 10.1016/j.ctrv.2020.102103.
[7] Clevers H. Modeling development and disease with organoids. Cell. 2016;165:1586–1597. doi: 10.1016/j.cell.2016.05.082.
[8] Drost J., Clevers H. Organoids in cancer research. Nat. Rev. Cancer. 2018;18:407–418. doi: 10.1038/s41568-018-0007-6.
