胰腺导管腺癌(PDA)是一种高致死性的恶性肿瘤,其发病率不断上升,预后不佳,急需开发有效的治疗PDA的方法。十多年来尽管针对肿瘤代谢的治疗一直是研究的重点,但PDA肿瘤代谢的可塑性和潜在毒性限制了这种治疗策略。近期来自美国波士顿儿童医院的Nada Y. Kalaany 团队利用15N谷氨酰胺同位素示踪及代谢组学技术揭示胰腺癌细胞通过鸟氨酸转氨酶(OAT)促进多胺合成进而促进肿瘤生长的重要机制,使用OAT抑制剂可有效抑制胰腺癌细胞增殖,相关研究成果发表于Nature。

PDA通过谷氨酰胺生成多胺
作者之前的研究发现,谷氨酰胺氨基上的氮被直接输送到独立于尿素循环的鸟氨酸的从头合成(DNS)。这种OAT催化的可逆反应主要限于婴儿早期的鸟氨酸和精氨酸合成。相比之下,大多数成年人的组织倾向于相反的方向,降解鸟氨酸以生成谷氨酸。在成人中,鸟氨酸通常是通过精氨酸酶(ARG1和ARG2)从精氨酸中产生的,既可作为尿素循环中瓜氨酸合成的底物,也可作为多胺类物质的前体,包括腐胺、亚精胺和精胺。这些分子参与了细胞生长和生存的多个基本过程。那么在PDA中,谷氨酰胺衍生的而非精氨酸衍生的鸟氨酸,是否作可作为一个特殊的多胺来源呢?
首先,通过同位素示踪法用15N谷氨酰胺培养人AsPC-1细胞,结果显示,谷氨酰胺的氮未转移到瓜氨酸、精氨酸、精氨酸或尿素中;相反,检测到其转移到鸟氨酸中,表明DNS的发生,因为即使尿素循环是活跃的,这种氮也会被传递给尿素而非鸟氨酸,使得DNS成为其转移到鸟氨酸的唯一途径。谷氨酰胺而非精氨酸被证明是PDA癌细胞系的鸟氨酸及其多胺衍生物腐胺的主要来源。与PDA癌细胞系不同,在人类胰腺导管上皮细胞(HPDE)和所有测试的非PDA癌细胞系中,精氨酸是鸟氨酸和腐胺的主要来源,其中高达87%的鸟氨酸和80%的腐胺来自15N-Arg,而只有40%的鸟氨酸和41%的腐胺酸来自15N-Gln。相比之下,所有PDA细胞系,除了非KRAS驱动的BxPC3细胞系,都更偏好谷氨酰胺:从15N-Gln中得到的鸟氨酸和腐胺高达71%,而从15N-Arg中得到的鸟氨酸和腐胺为35%。这些结果将PDA(其中90%以上的病例由KRAS驱动)与正常胰腺细胞和其他癌症类型区分开来,因为它使用谷氨酰胺而非精氨酸作为多胺合成的来源,且这一特征既不是来源于谷氨酰胺分解增强也不是由于其增殖增强。
随后探究其体内变化,给多西环素诱导的PDA小鼠模型(iKrasG12D)和无肿瘤对照组(iKrasWT)注入15N-Gln或15N-Arg。在所有小鼠中,在3小时内正常胰腺和肿瘤中分别达到约54%的15N-Gln和30-40%的15N-Arg的富集。且与正常胰腺组相比,PDA肿瘤中15N-Gln衍生的鸟氨酸和腐胺的合成率及其总量都显著升高。其中,PDA中谷氨酰胺分别占鸟氨酸标记和腐胺标记部分的45%和23%,而在正常胰腺中分别占19%和3%。相比之下,精氨酸是正常胰腺组中鸟氨酸(51%)和腐胺(16%)的主要贡献者,而PDA中只有14%的鸟氨酸和6%的腐胺来自精氨酸。这表明,与正常组织相比,PDA在体内多胺合成中主要使用谷氨酸而非精氨酸(图1)。
PDA的肿瘤微环境中精氨酸被耗竭
是什么原因导致了PDA倾向于利用谷氨酸合成多胺?研究者分别从iKrasG12D和iKrasWT小鼠中分离出胰腺或肿瘤间质液和血浆进行代谢组学分析,结果表明,血浆中的代谢物组成与是否患有肿瘤无关;且血浆代谢物含量与肿瘤间质液(TIF)的代谢物含量不相关,在正常胰腺间质液(NIF)和肿瘤间质液(TIF)之间存在显著差异。因此,与胰腺癌相关的代谢差异主要发生在TME(肿瘤微环境)内,而非血浆中。且与血浆相比,对照组小鼠的NIF中精氨酸水平都较低,这表明它们被胰腺和/或其微环境所利用。然而,只有精氨酸及其尿素循环前体瓜氨酸在TIF中被进一步耗竭,而谷氨酰胺的水平仍与血浆中的相似。最近发现,这种精氨酸的耗竭是由PDA的 TME中表达ARG1的骨髓细胞分解精氨酸所致,这进一步促进PDA细胞代偿性地重新合成精氨酸。因此,KRAS驱动的PDA细胞能够在完全没有精氨酸或含有与TIF相当水平的培养基中生存和增殖,尽管速度很慢。根据精氨酸在体内的低可利用性,推测PDA重新调整其代谢,以有利于其独特地使用谷氨酰胺进行多胺合成。总之,PDA细胞对谷氨酰胺合成具有独特使用性以适应其精氨酸缺乏的微环境(图1)。
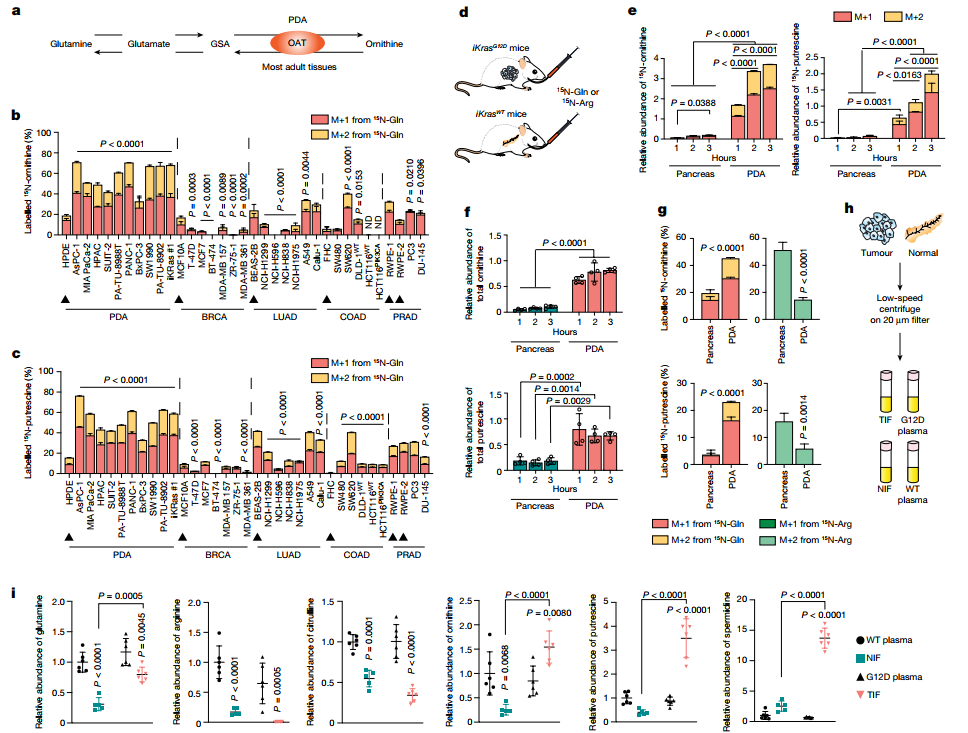
图1. PDA利用谷氨酰胺进行DNS和多胺的合成
PDA依赖于DNS
尽管人类胰腺组织中调控鸟氨酸从头合成(DNS)的OAT的mRNA水平在显著低于其他组织,但与正常胰腺相比,在PDA肿瘤中的OAT的mRNA和蛋白水平均增加。鸟氨酸除了通过OAT从谷氨酰胺产生,或通过ARG从精氨酸产生之外,还可以通过肌酸合成途径中的甘氨酸脒基转移酶(GATM)从精氨酸产生。
为了评估它们对多胺合成和肿瘤生长的不同贡献,在AsPC-1细胞中分别敲除三种鸟氨酸合成酶,并与敲除多胺合成的限速酶ODC1进行比较。选择ARG2而不是ARG1是因为ARG1在PDA细胞中的表达水平无法检测。结果显示,与ODC1相似,当敲除OAT而非ARG2或GATM后,才能抑制15N-Gln衍生的鸟氨酸和腐胺的合成。虽然敲除OAT后观察到15N-Arg衍生的鸟氨酸增加,但总的鸟氨酸水平并没有代偿性增加,也未影响腐胺的水平,表明对DNS的抑制不会导致PDA中精氨酸衍生的鸟氨酸或多胺合成的代偿性增加。相比之下,ODC1敲除导致其底物鸟氨酸的积累,并使OAT反应向鸟氨酸降解逆转;这又导致通过ARG2合成鸟氨酸(M+2)和尿素(M+2)以及通过GATM产生肌酸和肌酐(M+2)的15N-Arg衍生的合成代偿性增加。随后,15N-Arg衍生的鸟氨酸被引向谷氨酸(M+1)和脯氨酸(M+1)的合成。因此,尽管ODC1或OAT的敲除同样抑制了多胺的合成,但敲除ODC1而非OAT可以代偿性地诱导精氨酸介导的鸟氨酸合成。敲除OAT而非ARG2或GATM,在抑制AsPC-1细胞增殖方面与敲除ODC1一致;且补充腐胺后,该抑制作用得到逆转,这表明,OAT是PDA细胞生长所必需的,而OAT介导的腐胺合成是生长维持的主要贡献者。
在胰腺正常导管上皮细胞中,敲除OAT抑制15N-Gln衍生的鸟氨酸和腐胺酸的低水平,同时诱导15N-Arg合成的代偿性增加;这反过来又导致了鸟氨酸和腐胺酸总库的增加,但不影响增殖。这些数据与PDA中敲除OAT的影响相反,在PDA中未观察到精氨酸衍生的鸟氨酸或腐胺酸的显著代偿性增加,且PDA细胞增殖显著减少,这揭示了OAT在胰腺癌细胞而非正常细胞中的关键作用以及其作为治疗靶标的潜力。
进一步探究PDA中对DNS的体内需求,监测来自人类PDA细胞的正位异种移植的生长,其中OAT或ODC1被敲除。结果显示,敲除OAT或ODC1抑制PDA的生长,在4周内均显著减小肿瘤大小。与体外结果一致,15N-Gln注入肿瘤小鼠体内后,在移植的Oat基因敲除(KO)肿瘤中,15N标记的鸟氨酸和腐胺水平都降低,表明DNS和多胺的合成都受到影响;但在Odc1基因敲除的肿瘤中,只有腐胺水平降低。总之,存在于TME中的多胺大多来自于PDA细胞,而不是非癌细胞,从而为通过抑制OAT来特异性和有效地靶向PDA提供治疗窗口(图2)。
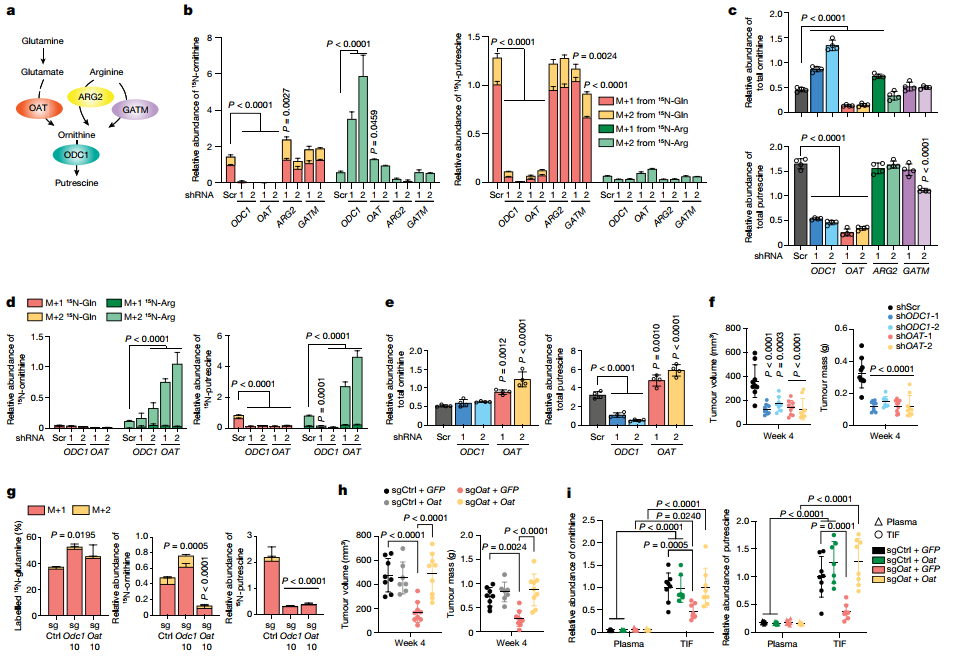
图2. OAT是PDA多胺合成和肿瘤生长的必要条件
KRAS驱动PDA的多胺合成
90%的胰腺癌中存在原癌基因KRAS突变,并促进肿瘤发生和发展。而在非KRAS突变的胰腺癌细胞系BxPC-3,其主要依赖于精氨酸用于多胺的合成,于是探究KRAS对DNS和多胺合成的调控作用。对多西环素诱导的iKras细胞系的分析表明,KrasG12D抑制15N-Gln衍生的鸟氨酸和腐胺水平,而15N-Arg衍生的鸟氨酸和腐胺水平无影响,这导致总鸟氨酸和腐胺减少;通过15N-谷氨酸归一化后依然如此,表明它的产生不是由于谷氨酸分解的增强。此外,KrasG12D在小鼠PDA细胞或其在人类PDA细胞中的敲除导致OAT、ODC1以及精氨酸合成和精氨酸合成酶SRM和SMS的mRNA和蛋白水平均下降,但不影响ARG2。这一现象被KRAS效应因子MEK的抑制剂(抑制剂AZD6244)所重现,而 PI3K(BKM120)、AKT(MK2206)或mTORC1(雷帕霉素)的抑制剂则不能重现,表明在PDA中KRAS-MEK轴调控鸟氨酸和多胺合成。
对PDA中所有四个关键的多胺合成基因(OAT、ODC1、SRM和SMS)共有的转录因子进行搜索,发现有六个在人类和小鼠之间保守的潜在候选基因位于OAT的转录起始位点附近:ZBTB14、SP1、KLF6、GTF2IRD1、CHURCH1和EGR1。进一步实验发现,沉默Klf6,但不沉默其他转录因子,显著下调Oat、Odc1、Srm和Sms的表达,但不影响Arg2;且在KrasG12D敲除后逆转,表明KLF6是KrasG12D的下游效应器。且敲除KLF6后抑制谷氨酰胺衍生而非精氨酸衍生的鸟氨酸或腐胺水平。因此,KLF6是KRAS驱动的DNS和多胺合成的转录上调中的一个关键因子(图3)。
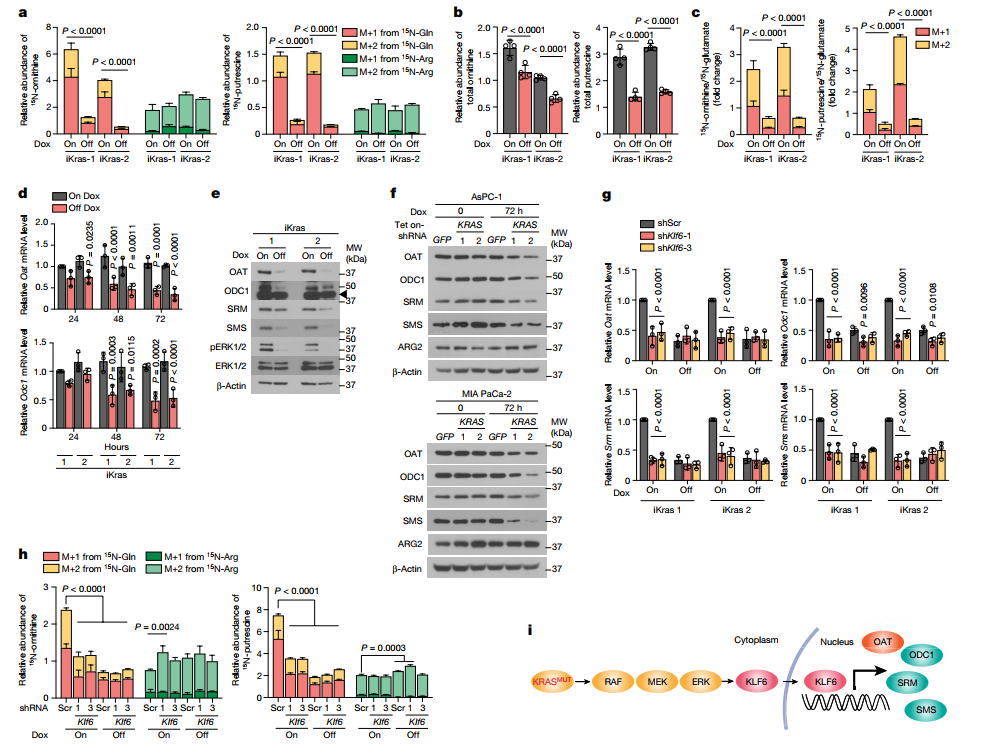
图3. KRAS促进PDA中DNS和多胺的合成
抑制OAT可缓解PDA进展
既然PDA依赖于OAT将谷氨酰胺转化为鸟氨酸,并通过ODC1将鸟氨酸转化为腐胺进而变成多胺以促进肿瘤生长,那么干预该代谢途径是否可以缓解PDA进展?研究者分别采用ODC1抑制剂(二氟甲基鸟嘌呤,DFMO)以及OAT抑制剂(5-氟甲基鸟嘌呤,5-FMO)进行比较。结果显示,用5-FMO处理人或小鼠PDA细胞时,显著抑制谷氨酸衍生的鸟氨酸和腐胺的合成,并有效地抑制PDA肿瘤细胞的增殖,且这一过程在乳腺癌细胞系中无法复现,表明5-FMO对胰腺癌细胞的特异性;而ODC1抑制剂DFMO的处理尽管表现出有效地抑制肿瘤细胞增殖的效果,但是其对非肿瘤细胞的抑制效果仍十分明显,表明DFMO不加区分地影响癌细胞和非癌细胞,存在潜在的毒性。
在体内,用5-FMO处理引起iKras小鼠对PDA的显著和剂量依赖性的抑制,这种影响伴随着鸟氨酸和腐胺合成的几乎完全被抑制,且身体未呈现消瘦及肝毒性。多胺类物质可以改变TME中的免疫群体,诱发对抗肿瘤免疫的逃避,于是探究其对TME的影响。在正位iKras PDA肿瘤中敲除Oat或Odc1并不改变CD8+T细胞的比例,但导致了CD4+T细胞显著增加。免疫抑制性粒细胞——骨髓源性抑制细胞的数量也有所减少,这与肿瘤较小及TME中多胺减少相一致。然而,这不太可能是多胺合成下降的主要抗肿瘤机制,因为在免疫缺陷小鼠中,人源肿瘤细胞中敲除OAT或ODC1仍能显著降低小鼠的肿瘤负荷(图4)。
OAT介导PDA的基因组及表观遗传改变
多胺可以影响转录、翻译和染色质结构,并从表观调控免疫细胞的激活和功能。然而,多胺如何改变癌细胞,特别是PDA的表观调控尚不清楚。对表达或敲除ODC1、OAT或ARG2的人类AsPC-1 PDA细胞进行转录组学检测,评估谷氨酸衍生的多胺与精氨酸衍生的多胺对PDA的转录改变的不同影响。结果显示,敲除OAT或ODC1的细胞共有的差异表达基因的数量大约是敲除ARG2或ODC1的细胞的两倍。聚类分析表明,ODC1敲除的差异表达基因与OAT敲除的细胞的转录变化的相似性高于ARG2敲除的细胞,后者与对照组更相似。ODC1是多胺合成的主要限速酶, OAT在为多胺合成提供鸟氨酸方面比ARG2有更大的贡献,且OAT的抑制对多胺诱导的转录变化有重大影响。
对PDA细胞进行转座酶可接触染色质的高通量筛选(ATAC-seq)检测,结果显示,敲除ODC1后,染色质可及性发生显著的变化,重点关注敲除ODC1和OAT后持有一致的共同变化的最大的差异表达基因簇(簇I,561个基因和簇V,403个基因),发现敲除ODC1和OAT而非ARG2,mRNA水平降低与簇I中染色质通路的减少一致;簇V中也是如此,这表明,OAT而非ARG2在多胺驱动的染色质通路改变中的作用,这些改变对应于基因表达的显著变化。对敲除ODC1的PDA细胞中所有2698个差异表达的基因进行基因组富集分析(GSEA),确定了前18个下调通路,涉及122个与细胞增殖、分化、对生长因子的反应、细胞因子和对饥饿的反应有关的基因,与敲除OAT或ODC1后的肿瘤生长抑制一致;且在补充腐胺后,从该组中随机选择的样本(7个基因)的表达得到恢复,进一步支持了OAT而非ARG2在多胺驱动的与PDA生长有关的转录和表观遗传学变化中的重要作用(图4)。
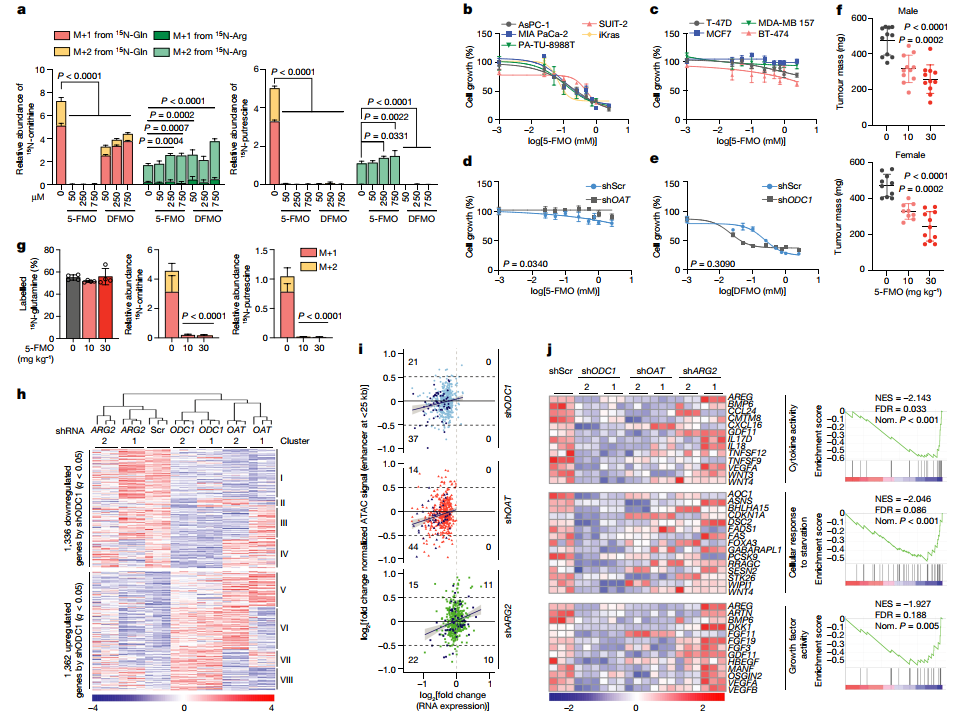
图4. 抑制OAT可缓解PDA并改变其转录和表观遗传
小结
本研究在人类和小鼠的体外和体内模型中使用利用15N谷氨酰胺同位素示踪及代谢组、基因敲除和抑制剂等方法,表明PDA对谷氨酰胺衍生的鸟氨酸合成有显著的依赖性。这一过程是通过OAT介导,它支持多胺的合成,是肿瘤生长所必需的。这种依赖性与PDA肿瘤微环境中的精氨酸耗竭有关,并且是由突变的KRAS驱动。激活的KRAS诱导OAT和多胺合成酶的表达,导致PDA肿瘤细胞的转录组和表观遗传的改变。PDA组织(而非正常组织)对OAT介导的从头合成鸟氨酸的独特依赖性,为OAT抑制剂治疗胰腺癌提供了一种具体而有效的策略,而且毒性最小。
参考文献
Ornithine aminotransferase supports polyamine synthesis in pancreatic cancer. Nature. 2023.
请扫描二维码阅读原文

绘谱帮你测
本研究利用同位素示踪及代谢组、基因敲除和抑制剂等方法,揭示胰腺癌细胞通过鸟氨酸转氨酶(OAT)促进多胺合成,进而促进肿瘤生长的重要机制。其中15N谷氨酰胺等代谢流分析,常规靶向和非靶向代谢组,腐胺,精胺,亚精胺,精氨酸,鸟氨酸的绝对定量麦特绘谱均可检测。本公司经典的已获得客户高度肯定的Q300全定量检测技术和升级的新品Q1000技术,均可精确捕捉到论文中提到的代谢途径中所有小分子产物的细微改变。目前Q300技术已助力客户在Science, Cell Metabolism, Gut, Advanced Science, Diabetes Care, Nature Communications, PNAS等权威期刊发表近70篇SCI文章,平均IF>10分。
往期回顾
1. 客户案例 | NC二连发!代谢组学-代谢流技术助力周文教授团队在多发性骨髓瘤研究中的新突破(二)
2. 客户案例 | NC二连发!代谢组学-代谢流技术助力周文教授团队在多发性骨髓瘤研究中的新突破(一)
4. 客户案例 | IF 19.87:胞外酸中毒限制T细胞一碳代谢以保护其细胞干性
5. Nature Immunology | CD8+T细胞通过尿素和瓜氨酸循环解氨毒以促进自身记忆发育
6. Signal Transduct Tar | 细胞核中存在非经典三羧酸循环连接代谢和表观遗传回路

