生命之美esiRNA产品介绍
1. 产品描述。esiRNA的英文全名是Endoribonuclease-prepared siRNAs,是通过大肠杆菌的RNase III(一种核糖核酸酶)切割长双链RNA(dsRNA)而生成的siRNA混合物,长度在18-25bp之间。可以高效敲除靶标基因的表达水平【图1】
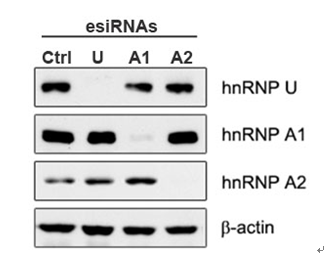
[图1] 生命之美科技有限公司(ABlife)制备的esiRNA进行基因沉默的效果。
2. 产品优势。
l 成功率高(³90%);
l RNAi效率高(一般均³70%);
l 不需反复摸索,使RNAi更快速简便;
l 最大限度降低脱靶效应,使RNAi结果更可靠;
l 可快速、经济的完成大规模RNAi筛选。
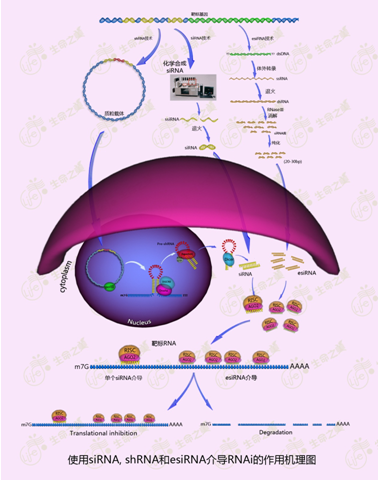
3. 产品作用原理。RNA干扰(RNAi,RNAinterference)是目前所知的、下调靶标基因表达的最有效手段,在科学研究和医药开发方面应用广泛。介导RNA干扰效应的小干扰双链RNA(siRNA,small interfering RNA)被转染进细胞后,整合到RISC复合体里,其中一条链通过碱基互补配对靶定到目标基因的mRNA或ncRNA上,而RISC复合体里的Argonaute蛋白介导目标RNA,从而达到下调基因表达的目的【图2】。
【图2】
4. 同类产品比较和使用建议。
(1)目前用于RNAi的siRNA主要分为siRNA,shRNA和esiRNA三种,其生成和作用机理的异同点见【图2】。
l esiRNA:选定靶标基因200-300bp的区域,通过PCR扩征获得该区域DNA,通过体外转录获得该区的双链RNA,再经过RNase III降解。成一个siRNA库,该库包含该基因区的所有可能siRNAs。
l 化学合成siRNA(synthetic siRNA):选定靶标基因一个20-22bp的区域,设计小干扰双链RNA的序列,并由化学方法分别合成两条链,在体外退火生成双链RNA,即siRNA。
l shRNA(small hairpin siRNA):选定靶标基因一个20-22bp的区域,设计小干扰双链RNA的序列,两条序列之间由一非配对的单链序列连接,克隆入一个表达质粒中。当质粒转染进入细胞后,转录出来的RNA形成一个发夹环结构(shRNA),类似siRNA初始转录本(pri-miRNA)的结构,该转录本在细胞内经Drosha和Dicer加工生成成熟siRNA。
(2)化学合成siRNA与shRNA共同的天然缺陷。
l 首次设计成功率难以保证。siRNA-RISC复合物与靶标RNA位点的结合会收到该位点二级结构、以及所结合蛋白质的阻挠[1]。目前mRNA的区域二级结构具有一定预测性,但是蛋白质的结合无法预测。同时,靶标位点的mRNA结构和蛋白质结合情况往往具有细胞特异性。因此,针对一个新基因在一个新细胞系,通常需要设计多个siRNA或者shRNA,才有可能找到一个有效的靶位点,而多数siRNAs或shRNA都会以干扰失败告终。
l 脱靶现象(off-target)难以避免。由于这两种方法设计与合成的siRNA对靶标mRNA的识别仅依赖20个左右的碱基配对,而且siRNA与mRNA即使是部分配对,也可以通过抑制其翻译等引起表达下调。因此一个下调靶标基因表达的siRNA非常有可能也引发其他拥有相似靶标位点的基因表达,从而干扰结论的可靠性。
(3)esiRNA的天然优势。esiRNA是克服了siRNA和shRNA的上述缺点而发展出来的一种高效的RNAi技术[2-4]。
l 靶标区域长,特异性高,有效避免了脱靶问题。靶标区一般为200-300bp,并且选择在每一个mRNA/ncRNA特异性强的区域。实验证明esiRNA的脱靶几率比化学合成siRNA低一个数量级[3]。
l 用上百条siRNA组成的混合库进行RNAi,有效提高了RNAi成功率和效率。由200-300bp靶标区经过RNase III消解产生的是针对该靶标区上百条不同的esiRNAs。因此,该靶标区所有不被二级结构或RNA结合蛋白保护的裸露RNA区域均可以被混合esiRNA库里的esiRNAs靶中。
(4)三种siRNA搭配使用的原则:
l esiRNA适合筛选目的基因使用,价格合理,首次成功率高。用于目的基因筛选,性价比最高。
l siRNA适合长期使用,针对同一个基因进行系统研究,首次摸索成本高,但是摸索成功后,成本可以有效降低。
l shRNA适合长期使用,针对同一个基因进行系统研究,首次摸索成本高,质粒构建周期长,但是获得有效的shRNA质粒后,成本有效被降低,重复性好。
l esiRNA也适合对siRNA和shRNA获得的实验结果进行验证,有效避免脱靶效应造成的假象。
5. esiRNA的应用举例。
(1) 全基因组筛选介导特定功能的基因。
2002年,美国旧金山加州大学的Mike Bishop实验室率先发明了esiRNA技术,并成功验证了该技术对人类多种细胞系及干细胞系中F-luc基因和R-luc基因的抑制作用[4]。
2004年,Kittler等使用5,305 esiRNAs来筛选出了37个在HeLa细胞分裂(cell division)中发挥重要功能的基因,包括几个剪接调控因子,文章在Nature上发表[2]。该团队继而对筛选策略进行优化,用esiRNA完成了从17,828个基因中筛选出影响HeLa细胞周期进程以及染色体倍数基因的工作,完成了对人类基因组中通过不同方式影响细胞周期进程的基因,对数百个未知功能基因赋予了细胞分裂的功能,对近千个其他功能基因注释了新功能。论文于2007年发表于Nature Cell Biology[5]。
2009年,Cell Stem Cell上有一篇文章报告esiRNAs技术被成功用于从小鼠胚胎干细胞(ESCs)中筛选与Oct4转录因子的调控基因[6]。该研究中使用了25,057个esiRNAs,发现296个拥有调控Oct4表达的功能,其中两个基因是Pol II-associating factor 1 complex (Paf1C)的组分。进一步研究表明,Paf1C结合在全能性相关基因的启动子区,对维持干细胞全能性相当重要。
(2) 从一类基因中筛选介导特定功能的基因。
2009年,Cell上发表的一篇文章成功使用esiRNA从59个候选基因中筛选能够显著降低53BP1 focus formation的基因,最终揭示出RIDDLE综合症蛋白在DNA受损位点介导泛素依赖的信号级联放大[7]。
2012年,在Molecular Cell上发表的一篇封面文章报道了由生命之美公司参与的一项研究成果,成功使用esiRNA技术从人类基因组所编码的340个潜在RNA结合蛋白中筛选出11个抑制7号外显子剪接的蛋白质,发现了降低hnRNP U表达可以大幅提升SMN2基因7号外显子的剪接效率,有望为脊髓性肌萎缩症的治疗提供新靶点[8]。
(3) 与化学合成siRNA一起使用,增强结论可靠性。
越来越多的研究发现,siRNA的脱靶现象比较普遍。为了有效避免该现象引起的假阳性结果,许多优秀的研究团队在使用化学合成siRNA对某一个基因的功能进行系统研究时,同时使用esiRNA,以有效增强所获得结论的可靠性[9]。