人血清白蛋白(HSA)在转运药物、代谢物和内源性配体方面起着举足轻重的作用。药物与HSA的结合可以调节游离药物的浓度,可以延长药物起作用的时间,并最终影响药物的吸收、分布、代谢和分泌(ADME)。这些特性使得药物与HSA的结合能力成为药物设计和评价备选药物分子的重要指标[1]。研究药物和蛋白的结合有很多方法,包括平衡透析、过滤、离心和色谱方法。然而这些方法的解析能力、重复性和通量都很有限。
表面等离子体共振(SPR)技术与传统的分析药物-蛋白相互作用的方法相比,有不少优势。它既不需要放射性元素也不需要荧光基团进行标记,就可以测定药物-蛋白相互作用的亲和力、特异性和动力学数据。这意味着所有的化合物都可以拿来分析,而不局限于那些可以加上标记基团的蛋白质。SPR也是一个高度灵敏的技术,样品的消耗远少于传统方法,却可以检测到皮摩级的蛋白和分子量仅有数百Dalton的化合物。它可以得到互作复合物的结合与解离动力学数据,而不像传统的方法只能进行稳态分析。最后一点,SPR可以做到高度自动化和高通量。
虽然SPR技术已经大量用于测定HSA和药物相互作用的动力学数据[2],[3],但直到最近,绝大多数实验的动力学数据测定都是顺序分析的。这种分析方式严重限制了药物研发的进度。与之相对照,ProteOnTM XPR36蛋白相互作用阵列系统却可以提供另外一种解决方案,叫做One-shot KineticsTM(一步法动力学)分析[4](Bio-Rad Laboratories, Hercules, CA)。该系统通过一个多通道的SPR装置形成了6 × 6的相互作用阵列,可以实现进样一次即可实现6个配基(Ligand)和6个分析物(Analyte)的相互作用分析,产生36个数据(图1)。多通道分析改善了传统SPR的工作流程,使得生物分子相互作用的定量分析实验可以平行进行。由于多个实验条件可以平行测试,一次实验就可以测试一系列的分析物浓度,从而进行动力学分析。这种平行式的一步分析法可以在单一一块芯片上,通过一次进样,即可得到生物分子间相互作用的详细动力学数据而无需反复再生。

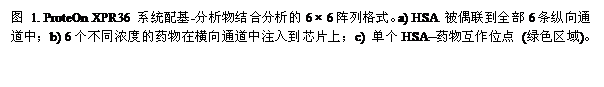
本文介绍了使用ProteOn XPR36系统进行小分子药物和HSA的互作动力学研究,充分展现了系统快速分析和精确测定的优势。实验用的各种药物分子量不同,和HSA互作的亲和力也有很大区别。这些药物有:corticosterone,一种甾体类激素;naproxen 和phenylbutazone,非甾体类抗炎药(NSAIDs);quinine,抗疟疾药;warfarin,一种抗凝药,与HSA结合的特性已有充分的研究。此外,一种可与HSA结合的荧光探针,dansylamide的互作动力学也同时加以测定。
HSA与药物相互作用的实时、非标记分析
对于SPR分析而言,配基——本文中就是HSA——是共价偶联在传感芯片表面上的,而与之结合的配对分子——本文中就是小分子药物——流过传感芯片表面。发生相互作用时,SPR检测器通过SPR共振角的改变检测传感芯片表面的折射率变化。当注入芯片的溶液从分析物(药物)变成缓冲液时,芯片表面上形成的蛋白复合物开始解离,SPR共振角就逐步复原。SPR共振角的变化用反应单位(Response Unit, RU)来衡量[5],用传感图线(Sensorgram)的形式记录(图2)。折射率的变化与传感芯片表面的质量变化成一定的比例,因此传感图线实际上显示的是药物与HSA结合随时间变化的情况。结合、解离和稳态分析的各个常数计算是通过数学模型进行曲线拟合来得到的,拟合时还需要知道某些反应条件。本文中药物和HSA的结合与解离都非常快,互作曲线呈现出一种类似“方波”的形态。

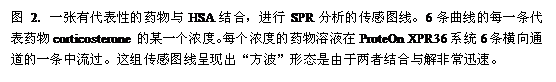
药物与HSA的亲和力
将不同浓度的一种药物同时注入6条水平通道,只需单次注入就可以获得这种药物与HSA相互作用全部的动力学参数。然后将6种不同浓度的第二种药物同时注入,又可以获得第二种药物的动力学参数。由于这种相互作用解离得很快,并且信号可以降低到基线,因此在两次注入药物之间无需再生。图3a显示6种药物的传感曲线,每一个曲线代表一个药物的某个浓度。正如图3所显示,为了与文献中所报道的数据进行比较,一些药物检测超过6种浓度。为检测平衡常数,在平衡期(稳态)我们根据药物浓度绘制了信号曲线(图3b)。根据以下公式,拟合了平衡常数KD:
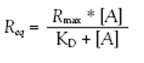 (1)
(1)
Req是每种浓度在平衡期的信号值,Rmax是所有白蛋白结合都被结合时的最大信号值,[A]是分析物浓度。对高亲和性化合物,要使用包含2个结合位点的模型:
 (2)
(2)
KD值根据上述公式拟合并计算出来,列在表1中。同时表1也列出了文献中根据传统SPR方法所获得的数据。从弱结合药物,如quinine,到强结合药物,如naproxen,与HSA作用的亲和力变化多达1000倍。平衡期结合数据传统上是通过平衡透析法计算出来的结合百分比,因此表1中的KD值根据参考文献2也被换算成结合百分比。根据数据显示,使用SPR方法所得到的数据与传统方法能很好地吻合。而使用ProteOn XPR36系统所检测的数据与文献报道的数据也非常一致。并且,6×6的相互作用模式以及一步法动力学分析可在获得同样多的数据的前提下,花费原有方法十分之一的时间。


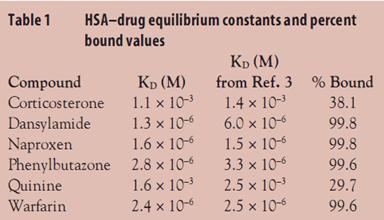
表1.
结论
新药研发中,尽早地收集有关候选化合物尽可能多的信息,有利于加快整个药物研发过程,从而推动了应用高通量方法分析HSA与药物相互作用的需求。尽管用SPR研究药物与HSA的结合具有高分辨率的方法,但顺序进样的方式限制了互作分析的通量。这些系统只用了一根注射针,这意味着每种药物的每个浓度都需要依次注入。因为每种药物需要几个浓度才能测定其亲和力,每个研究课题通常至少要测定10-20种化合物,所以说依次顺序地注射待测样品极大限制了SPR方法的通量。
ProteOn XPR36系统有6个注射泵,能在水平和垂直两个方向进行注射操作。这样HSA和其他血浆蛋白质可以结合到芯片表面的6根垂直通道。通过芯片旋转,不同浓度的候选药物可以同时注射到各个固定了血浆蛋白质的通道上。这样便实现了强大的单次进样动力学分析(一步法动力学分析)。通过再生,可以在同一个芯片上筛选多种候选药物。在得到等量的实验数据下,与其他SPR体系相比,ProteOn XPR36系统可以显著地将实验所需时间从几天减少到几个小时。由于其高通量的特性,The ProteOn XPR36系统具有更高的价值,可以更有效的满足制药产业中对药物快速筛选的需求,以及对化学复合物和血浆蛋白质亲和性的精确描述的需求。
[1] Bertucci, C.; Domenici, E. Reversible and covalent binding of drugs to human serum albumin: methodological approaches and physiological relevance. Curr. Med. Chem. 2002, 9, 1463–81.
[2] Rich, R.L.; Day, Y.S.N.; Morton, T.A.; Myszka, D.G. High-resolution and high-throughput protocols for measuring drug/human serum albumin interactions using Biacore. Anal. Biochem. 2001, 296, 197–207.
[3] Day, Y.S.N.; Myszka, D.G. Characterizing a drug’s primary binding site on albumin. J. Pharm. Sci. 2003, 92, 333–43.
[4] Bravman, T.; Bronner, V.; Lavie, K.; Notcovich, A.; Papalia, G.A.; Myszka, D.G. Exploring “One-shot” Kinetics and small molecule analysis using the ProteOn XPR36 array biosensor. Anal. Biochem. 2006, 358, 281–8.
[5] 标准的单位名称应该是折射率单位(Reflectivity Unit),英文缩写相同,都是RU——译者注。
