题目:lncRNA H19 regulates epithelial–mesenchymal transition and metastasis of
bladder cancer by miR-29b-3p as competing endogenous RNA
期刊:Biochim Biophys Acta
影响因子:6.261
主要技术:
1、病毒转染(慢病毒包装、腺病毒包装)
2、分子互作技术(Pull down、RIP(MS2/Ago)、双荧光素酶实验)
3、检测分析(免疫组化、克隆形成、细胞划痕愈合、CCK8、EdU、HE染色、WB、ELISA、q-PCR)
4、分子定位技术(FISH、IHC、免疫荧光、激光共聚焦)
5、芯片技术(lncRNA/mRNA芯片)
研究背景
EMT(epithelial-to-mesenchymal transition)是多种肿瘤发展中的一个关键步骤,主要在肿瘤的侵袭和转移中发挥作用。EMT的改变主要表现在分子、细胞、组织水平上,它涉及了组织细胞形态的改变,同时也涉及了组织特异分子表达的改变。通过检测相关分子表达水平或者通过检测相关细胞形态的改变可以评估肿瘤的进展、了解药物的疗效、基因的功能作用。lncRNA(long noncoding RNAs)与肿瘤的发生发展关系密切,越来越多的研究表明,lncRNA可以调控肿瘤细胞的增殖、迁移、凋亡、分化进而调控肿瘤的发生发展。
本文以膀胱癌和肿瘤侵袭为研究对象,聚焦EMT过程和lncRNA的功能机制,以lncRNA调控EMT的机制为主线,综合运用芯片、生物信息学分析、分子互作技术(RIP、RNA pulldown、双荧光素酶)、分子定位(免疫荧光、FISH)等技术研究了lncRNA的下游互作分子,探讨了H19(lncRNA)的功能机制。构建了H19调控膀胱癌侵袭、转移的作用轴线(如下图)。
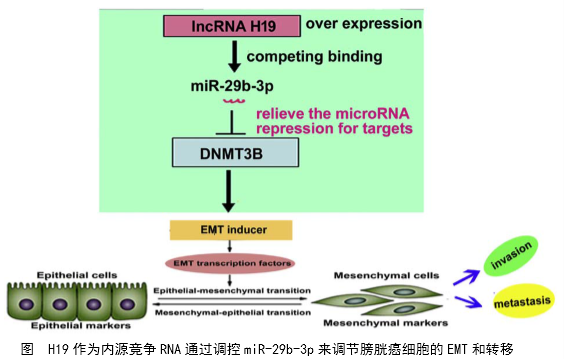
1、临床研究水平,研究了正常人和病人H19和DNMT3B的表达水平和相关性。
2、体外实验,寻找并综合运用多种技术手段验证了H19的相互作用靶分子miR-29b-3p及miR-29b-3p的相互作用靶分子DNMT3B
3、体内实验,运用裸鼠成瘤实验验证了H19对肿瘤侵袭转移的作用。
一、临床研究水平
研究了癌组织和癌旁组织以及膀胱癌细胞系中H19和DNMT3B的表达水平和相关性。发现H19和DNMT3B在癌组织中高表达而在癌旁组织中低表达。运用pearson correlation分析发现H19和DNMT3B的高表达具有正相关性。这暗示了H19对DNMT3B可能具有正调控关系。这是后面作者进行生物信息学预测和机制功能研究的基础。
1、作者首先统计了临床上H19的表达和膀胱癌患者性别、年龄、肿瘤病理分期、淋巴转移的关系。发现高表达的H19和膀胱癌的分期和淋巴转移存在密切关系(P<0.05)。
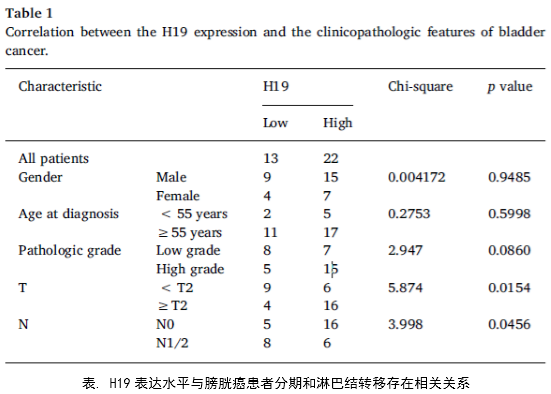
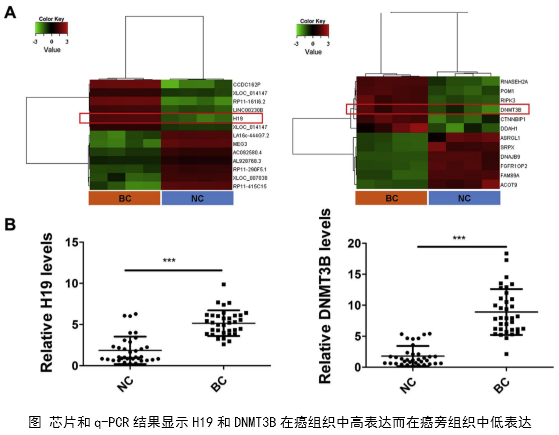
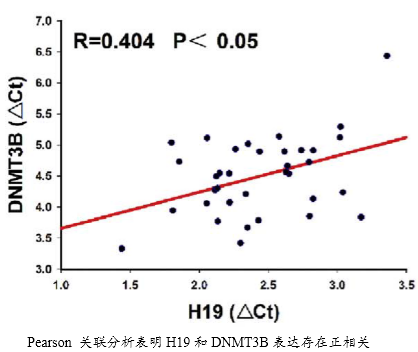
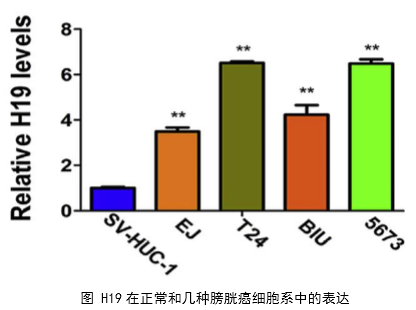
临床实验证实了H19与膀胱癌的分期、转移有密切的关系,同时H19和DNMT3B可能存在正调控关系。作者综合运用多种功能实验研究了H19的体外功能,在此基础上然后运用生物信息学分析方法和多种互作技术预测并且验证了H19的互作分子miR-29b-3p和下游调控靶分子DNMT3B。
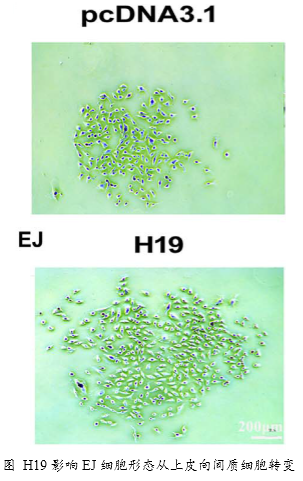
1、功能研究。作者综合运用CCK8、EdU、克隆形成、划痕愈合、Transwell、免疫荧光等技术对H19的生物学功能进行了研究,发现H19可以促进癌细胞的增殖、侵袭、迁移、转移和细胞骨架重构。
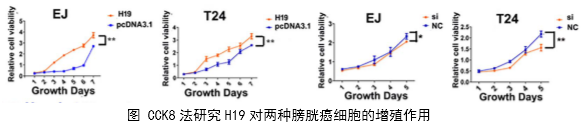
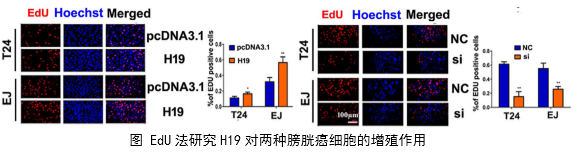

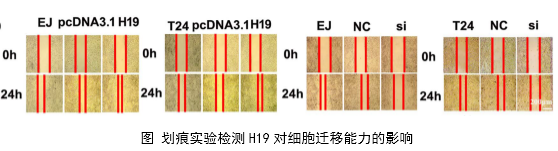
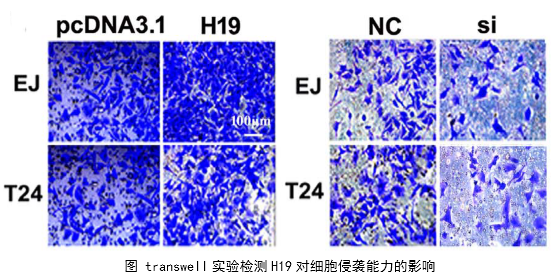
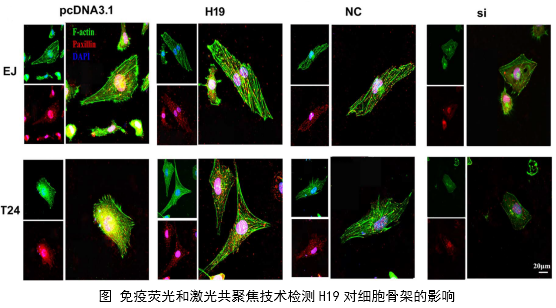

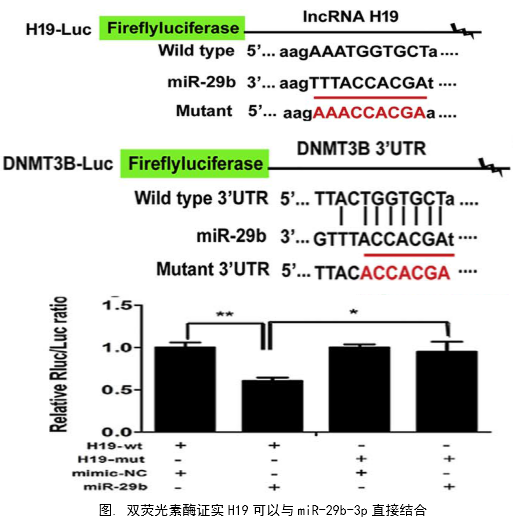
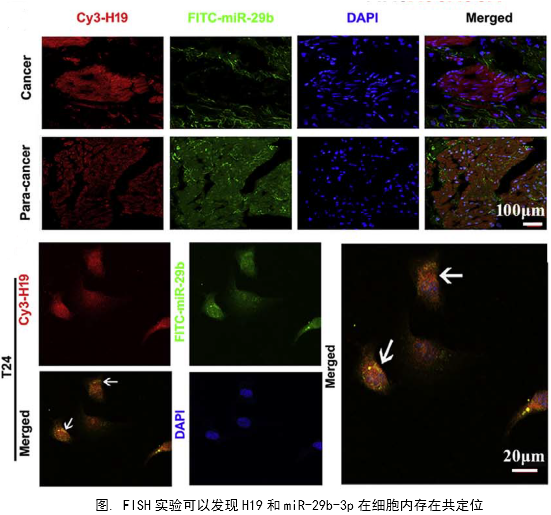
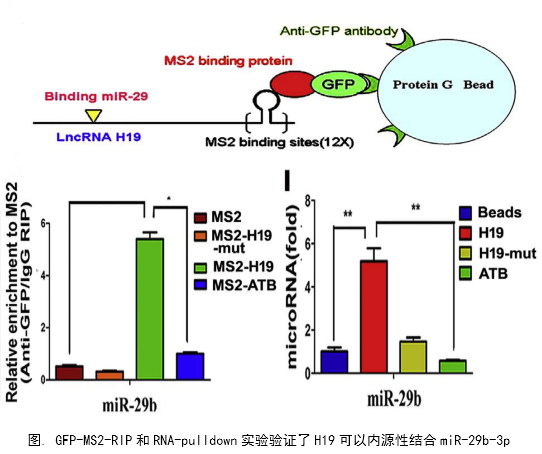
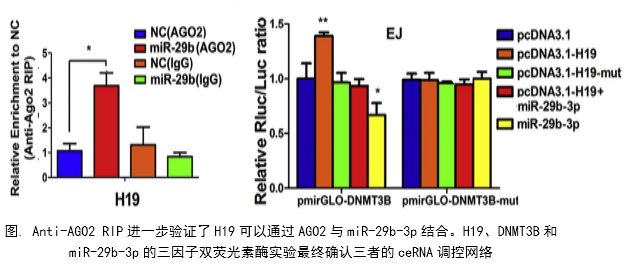
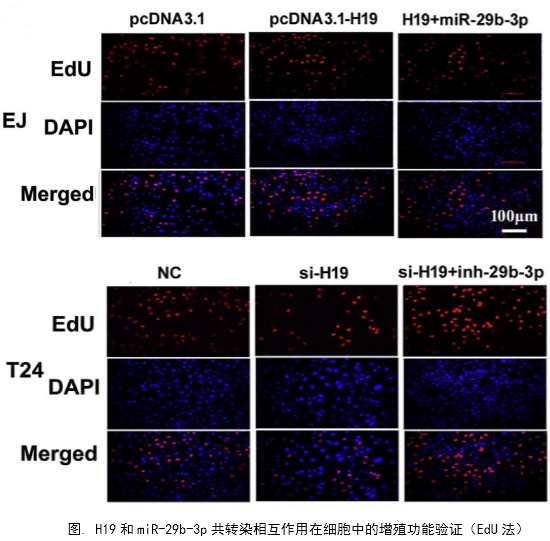
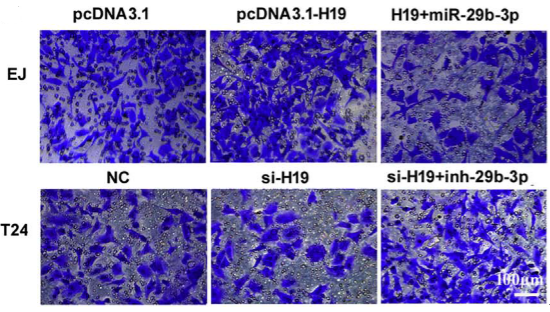
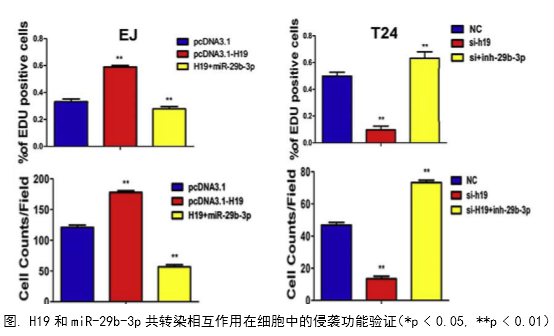

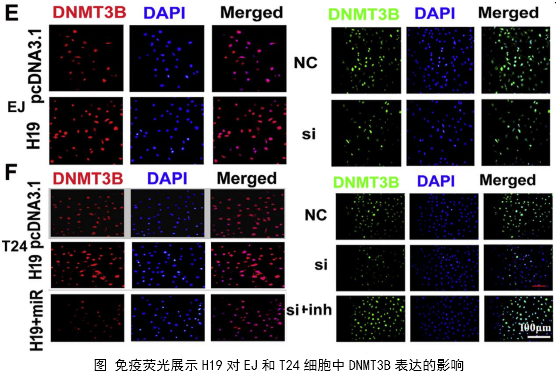
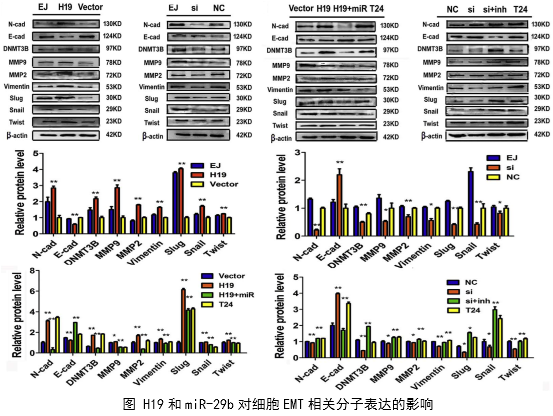
在几个膀胱癌细胞系的体外机制研究表明,H19与miR-29b、miR-29b与DNMT3B之间存在调控关系,H19作为ceRNA可以通过直接调控miR-29b来调控DNMT3B的表达,进而调控下游相关分子的表达和EMT相关功能的实现。接着作者用裸鼠成瘤实验验证了H19、miR-29b对膀胱癌细胞成瘤能力、转移能力、血管形成的影响。
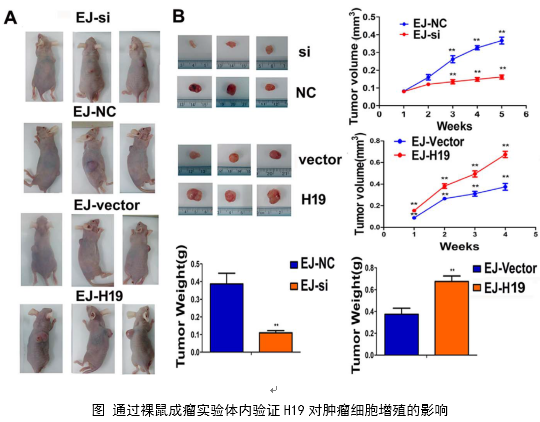
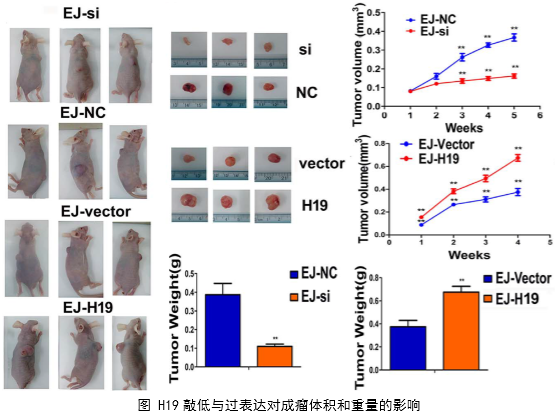
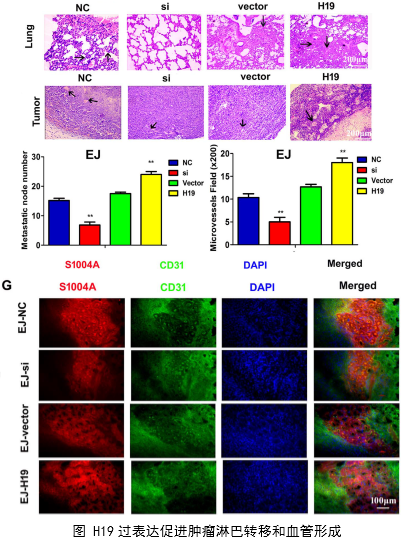
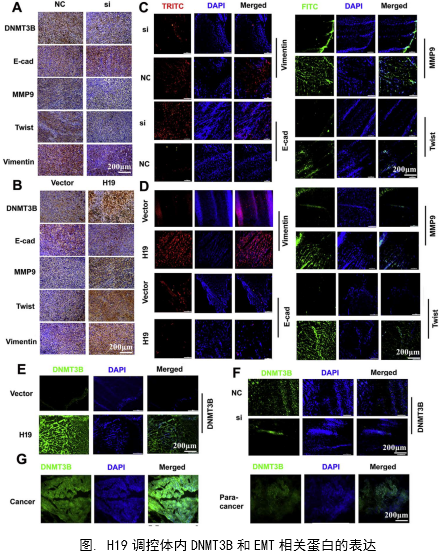
作者从临床案例入手,发现了膀胱癌与H19表达的关系,然后运用芯片技术和q-PCR进一步验证了膀胱癌中H19和DNMT3B存在正相关关系,生物信息学分析预测了由miR-29b调控DNMT3B表达的ceRNA网络关系。体外实验中,互作分子技术(双荧光素酶实验、RIP、RNA pulldown)验证了生物信息学的预测,功能实验验证了H19、miR-29b和DNMT3B三种在细胞增殖、侵袭、迁移、EMT转化中的作用和相互作用关系。接着作者进一步开展了体内实验,裸鼠成瘤实验证实了H19可以促进膀胱癌细胞的增殖、淋巴转移、血管生成。这样作者从临床、体外、体内三个水平探究了作为ceRNA的lncRNA(H19)在调控膀胱癌细胞侵袭转移EMT转化中的调控网络,描绘了H19/miR-29b/DNMT3B调控主线。
Lv M, Zhong Z, Huang M, Tian Q, Jiang R, Chen J. lncRNA H19 regulates epithelial-mesenchymal transition and metastasis of bladder cancer by miR-29b-3p as competing endogenous RNA. Biochim Biophys Acta. 2017 Oct;1864(10):1887-1899
1、Budhu A, Forgues M, Ye QH, et al. Prediction of venous metastases, recurrence, and prognosis in hepatocellular carcinoma based on a unique immune response signature of the liver microenvironment. Cancer Cell. 2006 Aug;10(2):99-111.
2、Fidler IJ. The pathogenesis of cancer metastasis: the 'seed and soil' hypothesis revisited. Nat Rev Cancer. 2003 Jun;3(6):453-8.
3、Ocaña OH, Córcoles R, Fabra A, et al. Metastatic colonization requires the repression of the epithelial-mesenchymal transition inducer Prrx1. Cancer Cell. 2012 Dec 11;22(6):709-24.
4、Massagué J. TGFbeta in Cancer. Cell. 2008 Jul 25;134(2):215-30.
5、Faghihi MA, Modarresi F, Khalil AM, et al. Expression of a noncoding RNA is elevated in Alzheimer's disease and drives rapid feed-forward regulation of beta-secretase. Nat Med. 2008 Jul;14(7):723-30.
