
期刊:Cell Reports
影响因子:9.995
导语
与哺乳动物不同,鸟类发生耳聋后可以自发愈合,是内耳再生的理想模型。从组织结构上讲,鸟类的听觉器官是基底乳突,与哺乳动物类同。基底乳突位于鸟类耳蜗管中,含有与支持细胞交叉的听觉毛细胞。鸟类耳蜗管中含有两类毛细胞:高毛细胞、矮毛细胞,高毛细胞位于听神经节上方的纤维软骨板上,即基底乳突的内侧/神经侧,短毛细胞位于基底膜上方的上皮中,横跨下纤维软骨板,即外侧/神经异常侧。毛细胞的分布与耳聋的治愈密切相关,但哺乳动物中鲜少发生毛细胞的再生。
科学问题
毛细胞的再生与耳聋治愈密切相关,哺乳动物中却鲜少发生,支持细胞为毛细胞提供支撑,但支持细胞的marker基因和亚型仍无研究。
研究技术
10X 单细胞RNA测序、RNA原位杂交
研究内容
为了阐明鸟类耳聋治愈过程中毛细胞再生与重排的分子机制,作者采用单细胞测序技术,发现了三类听觉毛细胞:高毛细胞、矮毛细胞、高级毛细胞,及三类毛细胞的marker基因。发现了支持给类毛细胞的支持细胞marker基因及功能。并鉴定了毛细胞基因沿耳蜗轴的分布,为与非再生哺乳动物耳蜗的比较研究和再生鸟类耳蜗的纵向研究提供了基础。
研究路线图
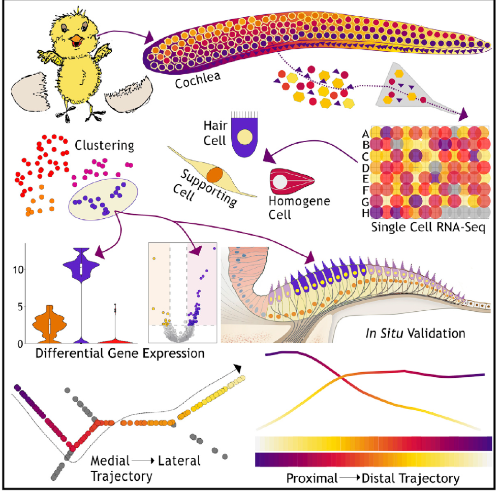
研究结果
1. 鸡耳蜗感觉上皮细胞的单细胞图谱
从组织学形态上讲,鸟类和哺乳动物的耳蜗具有类似的形态(Fig 1A、1B),说明耳蜗结构在进化上的保守性,研究鸟类耳蜗结构具有一定的指导意义。解离鸡类的耳蜗上皮进行单细胞测序,总共测到305个上皮细胞,可以分为3群:毛细胞、支持细胞、均质细胞(Fig 1C),差异基因分析发现,SLC34A2在毛细胞中高表达(以前报到为毛细胞簇高丰度蛋白),TECTB和GSN分别在支持细胞和均质细胞中高表达(Fig 1D-1I)。
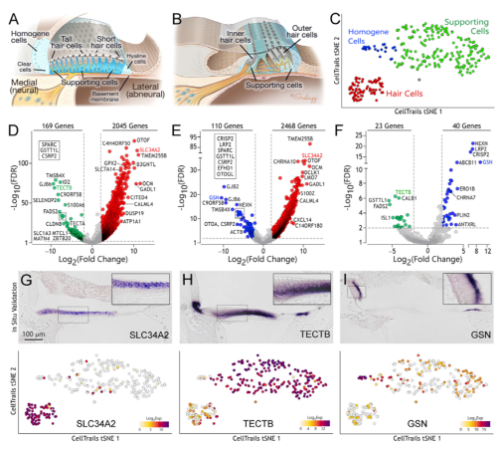
Fig. 1 鸡耳蜗单细胞图谱及细胞群的marker基因
2. 毛细胞亚群分析
作者将毛细胞进行亚群分析,共得到4个亚群:HC1-HC4(Fig 2A),说明了毛细胞的异质性,并发现C14ORF180和CXCL14在毛细胞中变异程度最高,且表达于明显不同的两群(Fig 2B-2D)。RNA原位杂交显示C14ORF180表达于高毛细胞,CXCL14表达于矮毛细胞(Fig 2B’、2C’),并揭示了高毛细胞和矮毛细胞的其他marker基因(Fig 2F-2I)。HC1与HC2进行比较发现,两群细胞各具有特异性高表达基因,包括ITM2C、NEFM(Fig 2J-2P)。

Fig. 2 毛细胞亚群分析
3. 毛细胞重排分析
作者先针对毛细胞群进行轨迹分析,高毛细胞和矮毛细胞显示了不同的分化轨迹,且发现TMC1和TMC2沿时序分析结果分布(Fig 3A),TMC1在时序近端,TMC2在时序远端(Fig 3B、3C),且TMC1和TMC2在高毛细胞和矮毛细胞中呈现相反趋势(Fig 3D-3F),有88个基因沿时序具有显著差异(Fig 4G)。
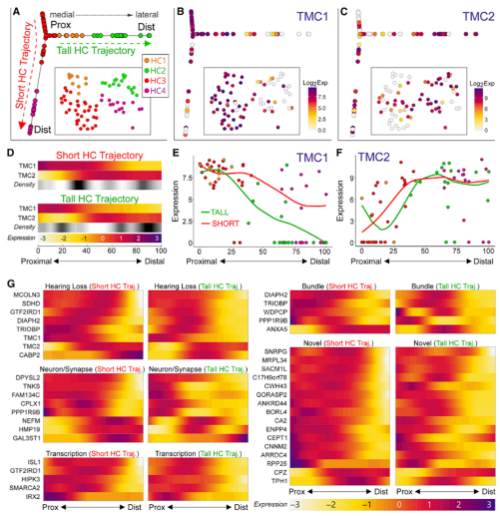
Fig. 3 毛细胞分布与重塑
4. 支持细胞亚型分析
将支持细胞进一步细分,也发现支持细胞可以分为两群细胞:SC1、SC2(Fig 4A),差异基因分析发现16个SC1高表达的基因,23个SC2高表达基因(Fig 4B)。拟时序分析发现支持细胞的空间关系(Fig 4C、4D)。SC1上调基因LCAT、GLIPR1L、DKK3的RNA原位杂交显示,SC1位于高毛细胞下方(Fig 6E-6G);SC2上调基因NTN4L、SMOC2、TIMP3原位杂交显示,SC2位于短毛细胞下方(Fig 6H-6J)。
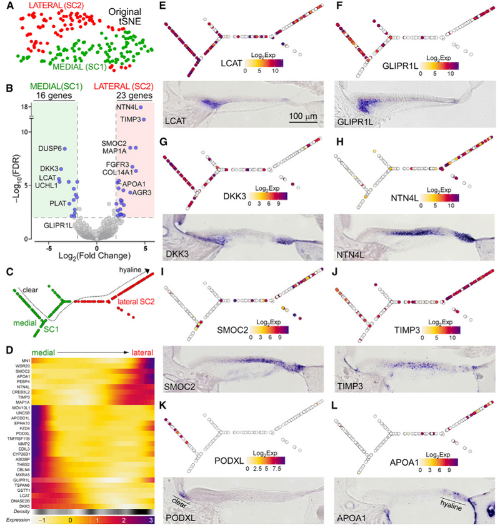
Fig. 4 支持细胞的异质性
5. 非听觉细胞的异质性
均质细胞与毛细胞和支持细胞相比,有37个高表达基因(Fig 5A、5B)。均质细胞高表达基因LRP2、CHRNA7 mRNA原位杂交结果显示,此类均质细胞位于血管背盖的上部;OTOA mRNA原位杂交结果显示,高表达OTOA的均质细胞位于基底和顶端区域,揭示了均质细胞的异质性(Fig 5C-7H)。通过拟时序分析,也证实了均质细胞的异质性,位于基底的均质细胞高表达基因与支持细胞marker基因共表达(Fig 5H-5L)。基于以上结果,作者提出了更加精确的鸟类耳蜗组织结构模型(Fig 5M)。
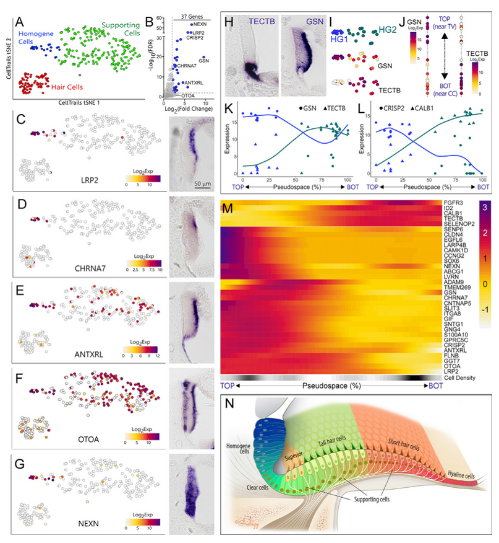
Fig. 5均质细胞的异质性
文章结论
通过对鸡耳蜗上皮进行单细胞测序,作者发现了三群耳蜗上皮细胞群:毛细胞、支持细胞、均质细胞。毛细胞亚群分析发现了高毛细胞和矮毛细胞的marker基因,及调控毛细胞重排的关键因子。支持细胞也分为两群:支持高毛细胞群和支持矮毛细胞群。均质细胞也具有一定的异质性,总体而言,提出了更加精确的鸟类耳蜗模型。
参考文献:
Janesick A, Scheibinger M, Benkafadar N, Kirti S, Ellwanger DC, Heller S. Cell-type identity of the avian cochlea. Cell Rep. 2021 Mar 23;34(12):108900. doi: 10.1016/j.celrep.2021.108900. PMID: 33761346.
