由于新病例的迅速增加,2019年冠状病毒(SARS-CoV-2)很快引起了全球关注。根据新型冠状病毒肺炎疫情实时大数据报告,截至7月31日18时,全国累计报告确诊病例88077例,现有确诊病例2195例,境外输入2063例;海外现有确诊病例5867747例。这些数字每天都会更新,而且预计可能还会进一步增加。迫切需要一种有效的预防该病毒的疫苗。
2020年7月29日,四川大学华西医院生物治疗国家重点实验室博士生导师魏霞蔚、逯光文和澳门科技大学医学院教授张康共同通讯在Nature 在线发表题为“Avaccine targeting the RBD of the S protein of SARS-CoV-2 induces protective immunity”的研究论文,这也是Nature杂志发表的第一篇新冠疫苗研究论文。该研究通过质谱分析(并使用GPSeeker软件分析完整的N-糖肽和聚糖)、表面等离振子共振、肺部组织的病理学分析等研究技术发现了SARS-CoV-2疫苗设计中S蛋白中RBD结构域的重要性,并为通过诱导针对RBD结构域的抗体开发保护性疫苗提供了依据。
下面我们一起来详细解读下这篇研究论文。

一、背景介绍
SARS-CoV-2是2019年在人体中发现的冠状病毒新毒株,到如今仍然在全球肆虐,给人们的健康以及全球的经济发展造成了灾难性的影响。如何治疗和预防这种疾病,成为了全世界最关心的事情之一。开发一种可行的疫苗,变得非常有必要,也是事在必行的事情。目前全球有很多医疗公司、科研院所都在致力于新型冠状病毒疫苗的研发。
前面已经有大量的文章报道,新型冠状病毒感染过程中的关键步骤是:SARS-CoV-2利用其S蛋白的受体结合域(S-RBD)与宿主细胞受体血管紧张素转换酶(ACE2)发生作用,从而侵染宿主细胞。
基于前面的研究和对病毒包膜蛋白的了解,作者假设受体结合域(RBD)是一种良好的免疫原,并可以触发有效的功能性抗体反应,从而在体外中和SARS-CoV-2。在这篇文章中作者用S-RBD的319-545残基组成的疫苗,在动物体内有很好的免疫应答,其产生的抗体在体外能阻断RBD与细胞表面表达的ACE2结合,并中和了SARS-CoV-2假病毒和SARS-CoV-2活病毒的感染。这些发现凸显了RBD结构域在SARS-CoV-2疫苗设计中的重要性,并为通过诱导针对RBD结构域的抗体开发保护性疫苗提供了依据。
二、RBD蛋白表达及相关研究
1、使用昆虫细胞和Bac-to-Bac 杆状病毒表达系统制备SARS-CoV-2刺突蛋白的重组受体结合结构域(RBD)。
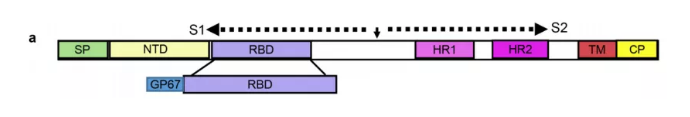
2、从培养上清液中纯化重组RBD蛋白,其纯度超过98%(图1b)。SDS-PAGE显示纯化的RBD蛋白的表观分子量为34 kDa,比理论上的RBD氨基酸序列的分子量(约27 kDa)大约1/4,由于刺突蛋白是糖蛋白,故作者认为RBD区域可能存在密集的蛋白糖基化修饰。
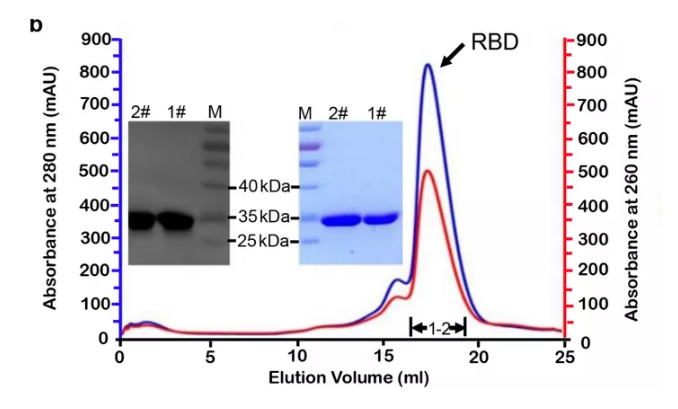
3、通过质谱(MS),使用GPSeeker软件分析完整的N-糖肽和聚糖。在天冬酰胺上鉴定出三个N-糖基化位点(图1c),其中N331和N343两个位点已有文献报道;此外,还使用SEQUEST分析MS结果,来评估O-糖基化位点,总共鉴定出十个O-糖基化位点。
4、将这些鉴定出的糖基化位点进一步定位在与ACE2结合的SARS-CoV-2 RBD的结构上。结果表明大多数糖基化修饰位点位于RBD核心子域上,且所有位点都远离结合的ACE2(图1e),这表明修饰的聚糖可能不会干扰RBD蛋白与受体的识别与结合。
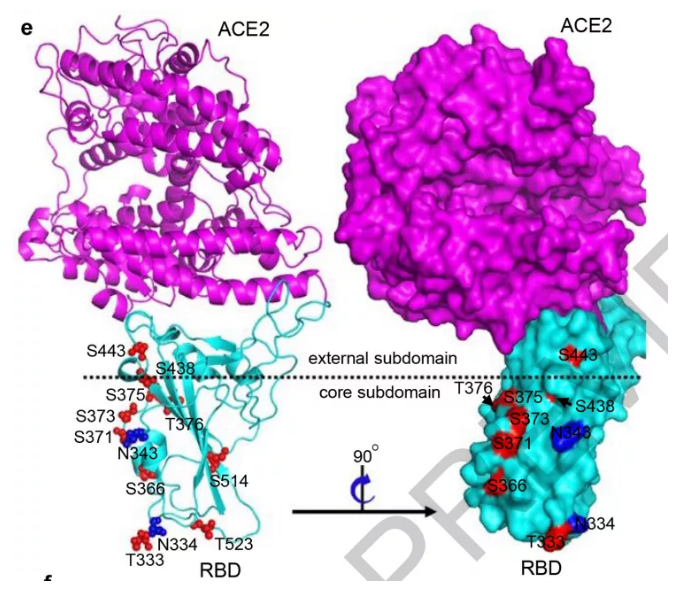
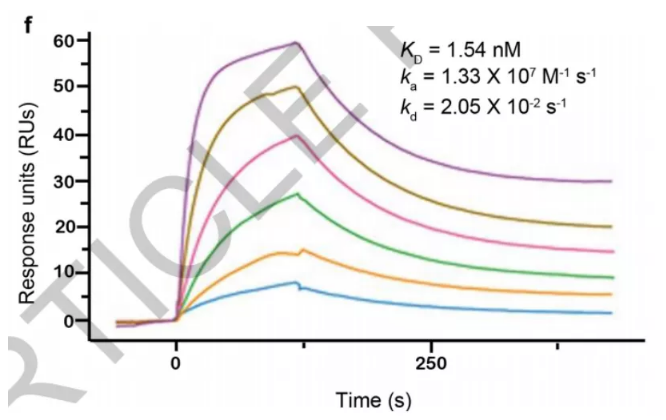
5、作者进一步通过表面等离振子共振技术验证了重组RBD蛋白与ACE2的亲和性,结果表明RBD以高亲和力与ACE2结合,这很好地反映出了重组RBD蛋白有天然构象。
三、RBD蛋白免疫动物获取抗血清并体外验证重组表达抗体的效果
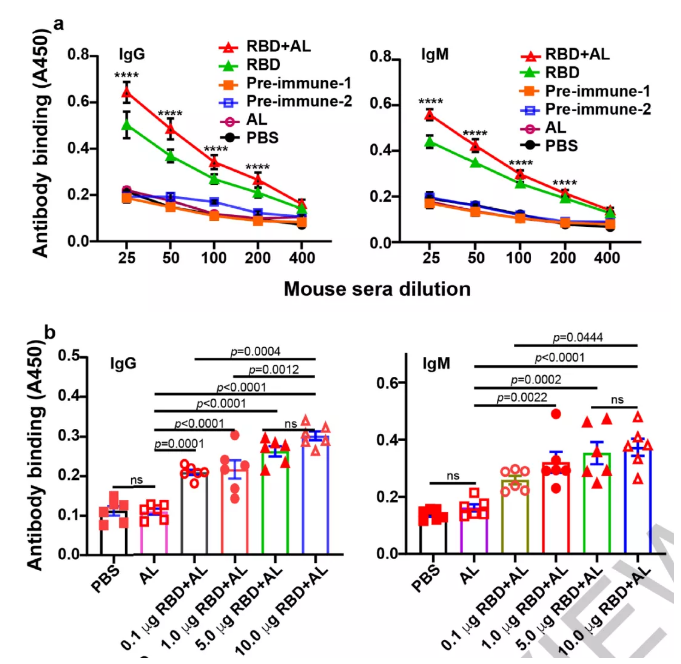
1、采用明矾作为佐剂,用不同的免疫剂量(0.1至20μg)和免疫方案免疫小鼠。并采用ELISA技术检测评估重组RBD诱导的体液免疫反应效果。
2、接种后第7天获得的血清已经显示出对重组RBD的IgG和IgM应答升高(图2a)。相反,来自免疫前的血清以及来自PBS和Alum免疫作为对照的血清仅具有背景水平的抗体反应。血清的抗体水平,随着免疫的RBD蛋白剂量增加而增加,两者在一定范围类存在剂量依赖(图b)
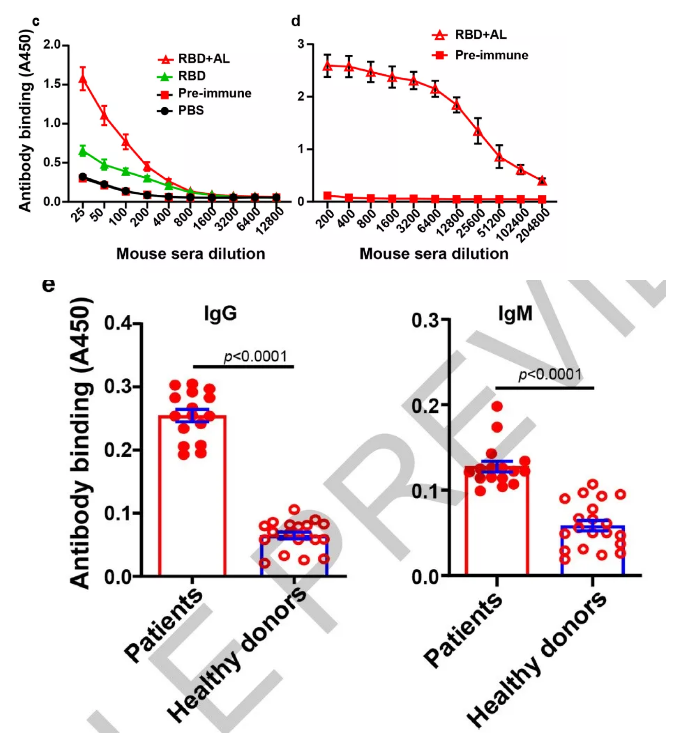
3、然后作者用SARS-CoV-2假病毒去测试血清抗体活性,同样得到较好的结果。接着作者选取了20位健康和16位COVID-19患者的血清检测重组RBD免疫得到的IgG和IgM,也显示出RBD重组抗体对病毒RBD蛋白的高响应和亲和性(图e)。
四、进一步测试抗血清对RBD与ACE2结合的阻断作用
1、在添加或不添加免疫血清的Huh7细胞培养体系中 ,以1:5的稀释度将重组SARS-CoV-2 RBD-Fc融合蛋白添加到ACE2阳性的Huh7细胞,发现免疫后的血清能大大减少RBD-ACE2阳性细胞的比率,抑制RBD与ACE2的结合。
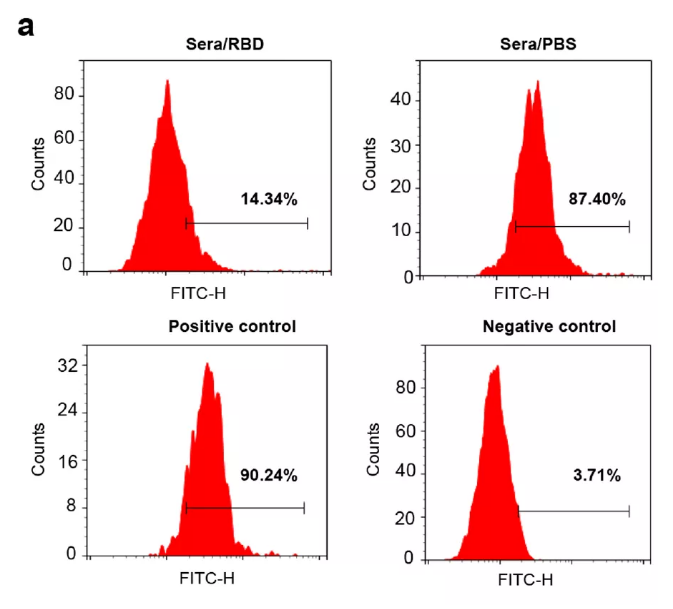
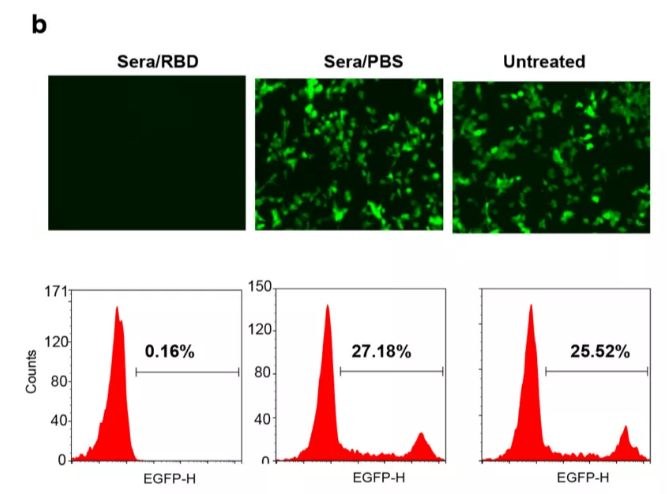
2、然后伪病毒中和实验,在添加猕猴免疫血清的293T ACE2阳性细胞中,免疫血清可以完全阻止SARS-CoV-2假病毒的与细胞的结合。
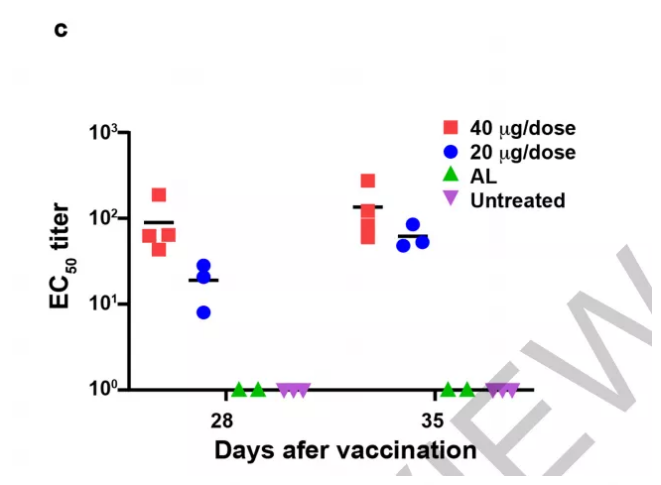
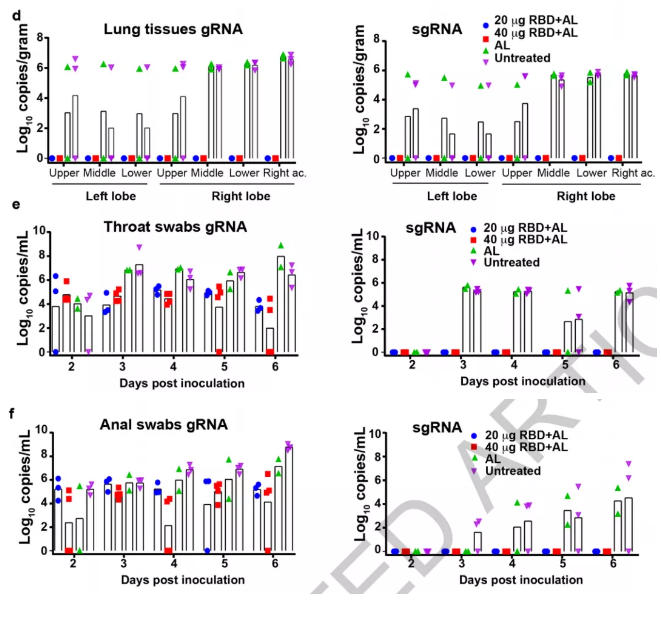
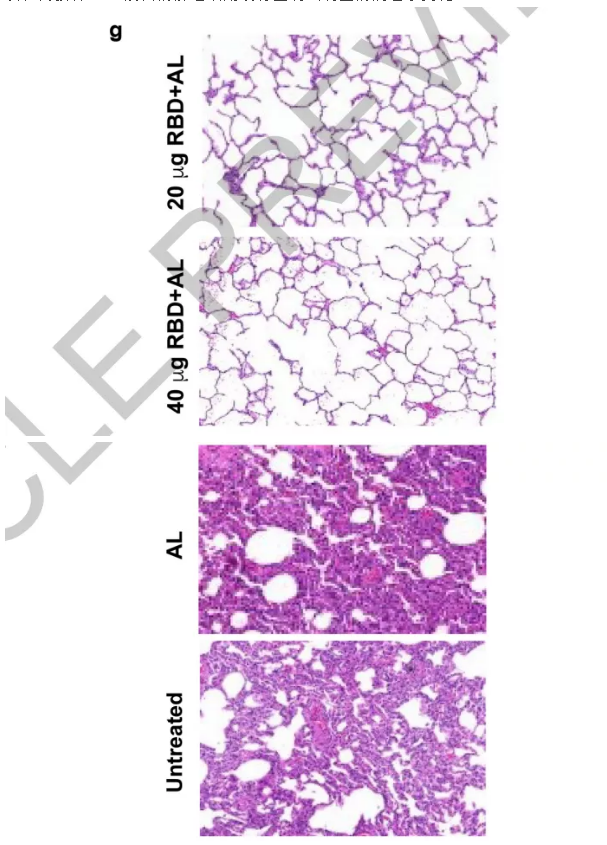
3、接下来,测试了接种RBD免疫血清(疫苗)的非人类灵长类动物是否可以阻断活SARS-CoV-2的感染。研究发现,当接种RBD疫苗后,在对动物的肺组织、咽拭子、肛门拭子的检测中,都未检测到或者检测到较低水平的病毒基因组RNA(gRNA)和病毒亚基因组RNA(sgRNA,指示病毒复制),而对照组(未接种RBD疫苗)检测到比较高含量的gRNA和sgRNA。此外,通过对不同接种量的比较,研究者还发现,当接种疫苗量提高时,其检测到的gRNA和sgRNA量会减少。
4、对肺部组织的病理学分析也表明,未接种RBD疫苗的肺组织出现明显的COVID-19症状,而接种RBD疫苗的肺组织则没有显现出明显的病理学变化。
综上所述,作者发现重组RBD蛋白具有良好的体液反应效果,像Alum这样的简单疫苗佐剂可以进一步增强免疫反应,其血清抗体与ACE2有共同结合表位;RBD疫苗具有很强的病毒中和活性,可以保护非人类灵长类动物免受SARS-CoV-2活病毒的攻击;在非人类灵长类动物中的毒理学研究表明,该候选疫苗是安全的。另外,这种重组RBD疫苗方法在技术上和商业上都是能大规模生产和制造的。
所有这些特征都支持该候选疫苗的在进一步开发方面具有极好的前景。总之,作者的发现突出了SARS-CoV-2疫苗设计中S蛋白中RBD结构域的重要性,并为通过诱导针对RBD结构域的抗体开发保护性疫苗提供了依据。
更多糖基化研究文章请点击:为什么说新冠病毒疫苗研发困难重重?
金开瑞糖基化修饰鉴定
糖基化是在酶的控制下在蛋白质或脂质上附加糖类的过程,起始于内质网,结束于高尔基体。在糖基转移酶作用下将糖转移至蛋白质,和蛋白质上的氨基酸残基形成糖苷键,并在糖基转移酶和糖苷酶的剪切、加工下形成各种类型的糖链。
糖基化蛋白质组学的核心任务是利用组学的手段,从全局上去寻找发生糖基化修饰的位点,解析糖链的结构,鉴定完整的糖肽,探索糖蛋白在生命活动中扮演的角色和生物学功能。
优势小结
基于GPSeeker软件的糖基化修饰鉴定
1、除了能够确定蛋白发生糖基化修饰的位点外,还能依赖开发的”GPSeeker”搜库软件对该位点发生糖基化修饰的糖链结构进行分析;
2、能知道发生糖基化修饰位点上的完整糖链信息;
3、基于完整N-糖肽液-质联用分析特征所发展稳定同位素标记可实现疾病差异表达糖基化的相对和绝对定量。