胶质母细胞瘤(GBM)是胶质瘤中恶性程度最高的颅内肿瘤,往往呈侵袭性的生长方式,跟正常的脑组织边界不清楚,所以手术切除非常困难,复发率非常高,往往难以治愈。通过联合手术、联合放疗化疗在内的综合治疗,临床报道平均生存期大概仅15个月左右。因此,产生了对新疗法的迫切需求。
免疫毒素疗法在治疗癌症方面具有巨大潜力,最近的研究发现,D2C7免疫毒素(D2C7-IT)在GBM小鼠模型和用D2C7治疗的患者显示出有希望的结果,但其疗效有限。GBM肿瘤具有难以置信的异质性,导致治疗耐药性,此外,癌症和肿瘤相关细胞经常分泌蛋白或表达受体,抑制免疫活性,从而形成阻碍疗效的免疫抑制环境。需要新的策略来克服GBM TME的挑战。
刺激免疫活性的分子可以帮助克服癌症细胞介导的免疫抑制。CD40是一种由不同类型细胞表达的共刺激分子,可增强T细胞活性和抗肿瘤免疫。抗CD40的激动剂抗体已被证明可激活适应性免疫和先天免疫,并可特别有效地对抗CD40高表达的癌症类型,包括GBM。
免疫细胞的功能分析显示了疗法如何影响免疫活动,但群体分析可能会漏掉每个细胞的关键特征。IsoPlexis的单细胞分泌解决方案帮助研究人员分析单个细胞的功能,为免疫反应和驱动免疫活动的细胞功能提供更深入的见解。

最近杜克大学发表在Science Translational Medicine上一篇新的论文,题为“Immunotoxin-αCD40 therapy activates innate and adaptive immunity and generates a durable antitumor response in glioblastoma models”(免疫毒素-αCD40疗法激活先天性和适应性免疫,并在胶质母细胞瘤模型中产生持久的抗肿瘤反应),研究人员评估了免疫毒素和抗CD40激动剂联合治疗GBM的疗效。
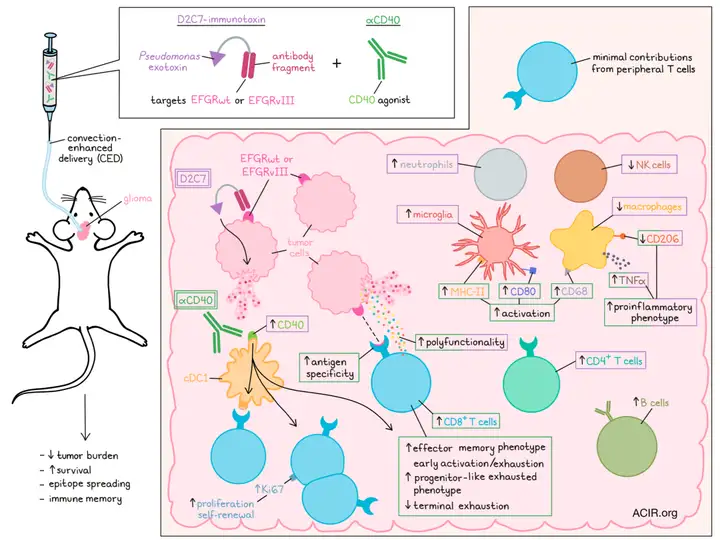
研究思路
研究者采用递送增强型给药方法(convection-enhanced delivery,简称CED),将导管(catheter)直接插入肿瘤之中,并通过注射泵(infusion pump)给予导管正压力,从而促进药物分布吸收。通过CED实现生物大分子直接瘤内给药,这些大分子往往难以通过血脑屏障,或者系统给药时毒性太高。
他们比较了四个治疗组中GBM小鼠模型的生存情况,分别为:
- Ctrl – 对照组no D2C7 or ɑCD40
- D2C7 – D2C7 单药
- CD40 - ɑCD40 单药
- D + C – D2C7 + ɑCD40 联合用药
在确定安全剂量后,研究人员表明,联合疗法能够诱导免疫记忆,最终改善GBM模型的存活率。研究人员接下来检查了受联合疗法影响的免疫细胞类型,发现CD8+肿瘤浸润淋巴细胞(TIL)是该疗法抗肿瘤作用所必需的。
文章的几个部分利用流式细胞术和免疫组织化学对治疗组肿瘤微环境中的某些免疫标记物进行表面表型和评估,发现:
- 联合治疗增加了促炎性小胶质细胞和肿瘤相关巨噬细胞的存在;
- CD8+T细胞是D+C联合的有效性所必需的;
- D+C联合导致CD8+肿瘤浸润淋巴细胞(TIL)的增加;
- 尽管这些TIL耗竭,但D+C治疗组的CD8+TIL仍相当活跃;
- D+C联合组的TIL增殖性更强,表明细胞毒性更强;
- D+C联合的疗效可以通过改变Batf3水平来调节,因为Batf3参与支持串扰和免疫群体(包括TIL)的扩增。
此外,来自肿瘤的RNA-seq显示,D+C联合治疗的小鼠肿瘤中促炎细胞因子转录物的增加。
单细胞功能蛋白质组学揭示增强的CD8+功能
由于联合疗法旨在刺激免疫细胞功能,研究人员使用IsoPlexis的单细胞分泌组来表征CD8+TIL活性。在四个治疗组(Ctrl、D2C7、CD40和D+C)中从GBM肿瘤中分离出CD8+TIL细胞,在37℃下用PMA/Iono刺激处理5小时,然后在小鼠单细胞适应性免疫芯片上检测细胞因子分泌组,并通过生信分析单细胞多功能亚群(分泌2种以上因子的细胞亚群)和细胞多功能指数(PSI)。
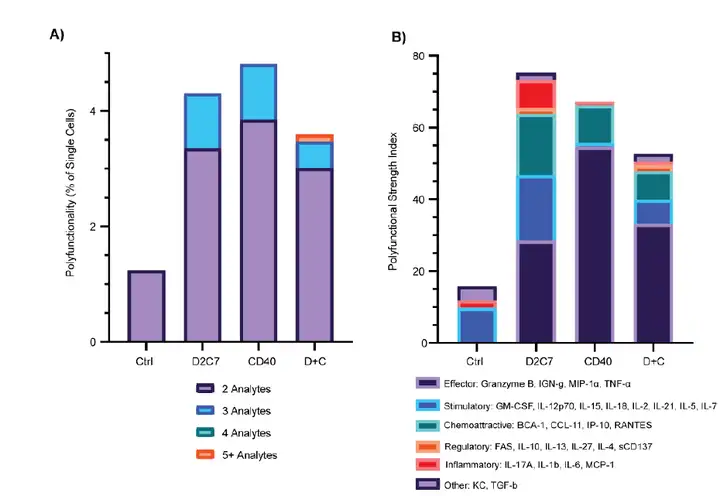
在CT-VIII胶质瘤治疗后6天,单个CD8+T细胞对不同疗法的反应,与对照组相比,D2C7、αCD40和D+C处理的小鼠显示出增强的多功能性和多功能强度指数(PSI)。虽然单药治疗增加了多功能细胞的数量,但只有联合治疗导致分泌5种或更多不同家族的细胞因子/趋化因子的高度多功能细胞亚群。
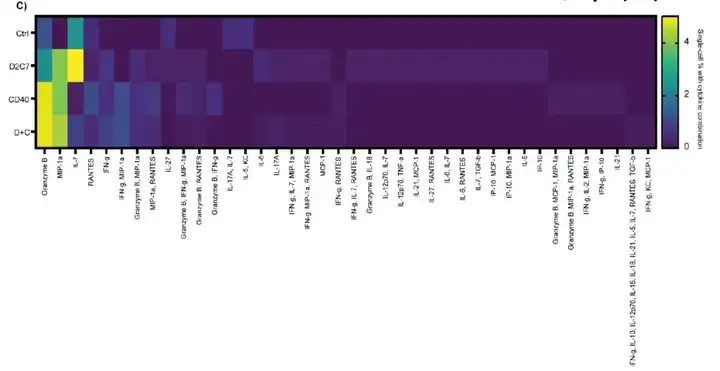
利用热图可视化来更好地了解治疗组中分泌的细胞因子/趋化因子,评估分泌的单个细胞因子表明,免疫毒素和联合疗法都增加了分泌的细胞因子的多样性,表明多功能细胞具有促炎表型,从蛋白组层面进一步验证了RNA-seq的发现。D+C联合治疗的小鼠CD8+TIL细胞在各种家族中分泌10种以上的细胞因子/趋化因子,这些高度分泌的CD8+TIL仅在D+C治疗组中发现。通过使用单细胞功能表型,研究人员能够识别驱动抗肿瘤免疫反应的CD8+TIL亚群,并表明他们的联合治疗可以提高T细胞功能,这符合他们最初的假设。
用单细胞分析评价新型免疫疗法
IsoPlexis的单细胞功能分析展示了新型免疫疗法如何在单细胞水平上影响免疫细胞功能,揭示了驱动免疫应答的高度多功能细胞亚群。多功能性和PSI是抗肿瘤疗效的有价值的生物标志物,使用单细胞功能分析来表征新的免疫疗法可以确定关键见解,并有助于指导新疗法的早期开发。

