基本信息
货号:15271
储存条件:保存在冰箱,避光
适用仪器:吸光板酶标仪
简介
烟酰胺腺嘌呤二核苷酸(NAD +)和烟酰胺腺嘌呤二核苷酸磷酸(NADP +)是在细胞中发现的两种重要的辅因子。 NADH是NAD +的还原形式。 NAD形成NADP,通过酯键将磷酸基团添加到腺苷核苷酸的2'位置。 传统的NAD / NADH和NADP / NADPH测定基于监测340nm处NADH或NADPH吸收的变化。 NAD / NADH和NADP / NADPH测定的短紫外波长使得传统方法具有低灵敏度和高干扰。 AAT Bioquest的Amplite™比色NADH检测试剂盒为检测NADH提供了一种便捷的方法。 NADH探针是一种生色传感器,在NADH减少时具有460nm的最大吸光度。 NADH探针的吸收与溶液中NADH的浓度成正比。 Amplite™比色NADH分析试剂盒提供灵敏的分析,可在100μL分析体积中检测低至3μM的NADH。
试剂盒组成
96孔板的检测分析
简要概括
准备NADH反应混合物(50μL)®
添加NADH标准品或测试样品(50μL)®
在室温下孵育15分钟至2小时®
监测460 nm处的吸光度
注意:在开始实验之前,在室温下解冻每个试剂盒组分中的一个
操作步骤
1.准备NADH储备溶液:
将200μLPBS缓冲液加入到NADH标准品(组分C)的小瓶中以制备1mM(1nmol /μL)NADH储备溶液。
注意:未使用的NADH储备溶液应分成单次使用的等分试样并储存在-20℃。
2.准备NADH反应混合物:
将1mL NADH探针(组分A)加入4mL NADH测定缓冲液(组分B)中,并充分混合。
注意:5mL NADH反应混合物用于一个96孔。未使用的NADH反应混合物应分成单次使用的等分试样并储存在-20℃。
3.准备NADH标准品的连续稀释液(0至100μM):
3.1将100μL的NADH储备液(来自步骤1)加入400μLPBS缓冲液(pH 7.4)中,生成200μM(100 pmol / L)NADH标准溶液。注意:稀释的NADH标准溶液不稳定,应在4小时内使用。
3.2取200μL的200μMNADH标准溶液进行1:2连续稀释,得到NADH标准品的100,50,25,12.5,6.25,3.13和0μM连续稀释液。
3.3如表1和2所述,将NADH标准品和含有NADH的测试样品的系列稀释液加入白色/透明底96孔微量培养板中。注意:根据需要制备细胞或组织样品。
表1白色/透明底96孔微孔板中NADH标准品和测试样品的布局

表2每个孔的试剂组成

*注意:将连续稀释的NADH标准品(3.13μM至200μM)加入NS1至NS7的孔中,一式两份。
4.在上清液反应中运行NADH测定:
4.1将50μL的NADH反应混合物(来自步骤2)加入NADH标准品,空白对照和测试样品的每个孔中(参见步骤3.3),使总NADH测定体积为100μL/孔
注1:对于384孔板,每孔加入25μL样品和25μLNADH反应混合物。
注2:根据需要准备细胞或组织样本。 为方便起见,裂解缓冲液(组分D)可用于裂解细胞(详见附录)。
4.2在室温下孵育反应15分钟至2小时,避光。
4.3使用吸光度读板仪在460 nm处监测吸光度的增加。
数据分析
空白孔中的吸光度(仅使用PBS缓冲液)用作对照,并从具有NADH反应的那些孔的值中减去。 NADH标准曲线如图1所示。
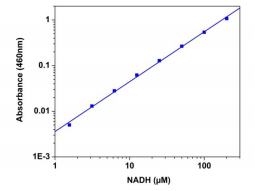
图1。 使用SpectraMax酶标仪(Molecular devices),使用Amplite™比色NADH分析试剂盒在96孔白色/透明底板中测量NADH剂量反应。孵育30分钟可检测到低至3μM的NADH(n = 3) 在460nm处测量吸光度。
附录:使用组分D(裂解缓冲液)的测试样品制剂
1.植物细胞样品:用200mg / mL的裂解缓冲液均质化,并以2500rpm离心5-10分钟,使用上清液进行测试。
2.细菌细胞样品:离心收集细菌细胞((10,000 g,0°C,15 min)。使用约1亿至1千万细胞/ mL裂解缓冲液,将处理后的溶液在室温下保持15分钟.2500℃离心 转速5分钟,用上清液进行试验。
3.哺乳动物细胞样品:从平板孔中取出培养基,每1-5百万个细胞使用约100μL裂解缓冲液(或在96孔细胞培养板中使用50-100μL/孔),并将处理过的溶液保持在室温下 15分钟。 直接使用细胞裂解液或以1500 rpm离心5分钟,使用上清液进行测试。
4.组织样品:称取约20mg组织,用冷PBS洗涤。 在微量离心管中用400μl裂解缓冲液均化。以2500rpm离心5-10分钟,使用上清液进行测定。
参考文献
1. Eugenia Villa-Cuesta, Marissa A. Holmbeckand David M. Rand. Rapamycin increases mitochondrial efficiency by mtDNA-dependent reprogramming of mitochondrial metabolism in Drosophila. Journal of Cell Science (2014) 127, 2282–2290 doi:10.1242/jcs.142026.
2. Chao Tong, Alex Morrison, Samantha Mattison, Su Qian, Mark Bryniarski, Bethany Rankin, Jun Wang, D. Paul Thomas, and Ji Li. Impaired SIRT1 nucleocytoplasmic shuttling in the senescent heart during ischemic stress. FASEB J, Nov 2013; 27: 4332 - 4342.
3. Rubin Tan, Jiansha Li, Xiaochun Peng, Liping Zhu, Lei Cai, Tao Wang, Yuan Su, Kaikobad Irani, and Qinghua Hu. GAPDH is critical for superior efficacy of female bone marrow-derived mesenchymal stem cells on pulmonary hypertension. Cardiovasc Res, Oct 2013; 100: 19 - 27.
4. Stephen Y. Xue, Valeria Y. Hebert, Danicia M. Hayes, Corie N. Robinson, Mitzi Glover, and Tammy R. Dugas. Nucleoside Reverse Transcriptase Inhibitors Induce a Mitophagy-Associated Endothelial Cytotoxicity That Is Reversed by Coenzyme Q10 Cotreatment. Toxicol. Sci., Aug 2013; 134: 323 - 334.
5. Kate J. Roberts, Andrew Cross, Olga Vasieva, Robert J. Moots, and Steven W. Edwards. Inhibition of pre-B cell colony-enhancing factor (PBEF/NAMPT/visfatin) decreases the ability of human neutrophils to generate reactive oxidants but does not impair bacterial killing. J. Leukoc. Biol., Sep 2013; 94: 481 - 492.
6. Weijing Cai, Maya Ramdas, Li Zhu, Xue Chen, Gary E. Striker, and Helen Vlassara. Oral advanced glycation endproducts (AGEs) promote insulin resistance and diabetes by depleting the antioxidant defenses AGE receptor-1 and sirtuin 1. PNAS, Sep 2012; 109: 15888 - 15893.
7. Yue Qiu, Claus Tittiger, Claude Wicker-Thomas, Gaëlle Le Goff, Sharon Young, Eric Wajnberg, Thierry Fricaux, Nathalie Taquet, Gary J. Blomquist, and René Feyereisen. An insect-specific P450 oxidative decarbonylase for cuticular hydrocarbon biosynthesis. PNAS, Sep 2012; 109: 14858 - 14863. 8. Jaime Uribarri, Weijing Cai, Maya Ramdas, Susan Goodman, Renata Pyzik, Xue Chen, Li Zhu, Gary E. Striker, and Helen Vlassara. Restriction of Advanced Glycation End Products Improves Insulin Resistance in Human Type 2 Diabetes: Potential role of AGER1 and SIRT1. Diabetes Care 2011; 34: 1610 - 1616.
