简介
氮杂吲哚及其衍生物具有显著的生物活性,因此在药物优化策略方面受到广泛关注。四种氮杂吲哚位置异构体通过稠合的C-C键将吡啶和吡咯环连接在一起,同时具有成为吲哚或嘌呤体系的生物电子等排体所需的所有标准。使用氮杂吲哚代替其他双环稠合杂环可以调节和微调化合物的溶解度、pKa值和亲脂性、靶结合能力以及毒性等理化性质和药理性质。

图1.氮杂吲哚的四种氮杂吲哚位置异构体
合成
含氟杂环化合物具有适合用于医药和农业领域的独有优势,特别是它们在生物体内对膜、组织的穿透能力的增强,有助于含氟化合物的吸收、传递和扩散。含氟氮杂吲哚合成过程中的挑战是以往是通过Balz-Schiemann反应或通过亲电氟化实现的选择性芳香族氟化。
中性芳香族化合物亲电氟化的缺点是它通常会产生单氟化和多氟化产物的混合物。另一方面,Balz-Schiemann反应通过四氟硼酸重氮盐的受控热分解提供区域选择性的单氟芳基氟化物。
2003年,C. Thibault等人报告了两种合成4-氟-1H-吡咯并[2,3-b]吡啶(4-fluoro-1H-pyrrolo[2,3-b]pyridine),别名4-氟-7-氮杂吲哚的方法。
第一种方法利用了区域选择性的Balz-Schiemann氟化反应,这需要合成中间体胺[1]。在DMF中使用甲磺酰氯在C-4处对1H-吡咯并[2,3-b]吡啶7-氧化物进行区域选择性氯化[2]。使用氯化物和N-烯丙基胺进行Buchwald-palladium催化胺化[3]生成烯丙基胺。随后,在酸性醇溶液中使用碳钯进行脱烯基化,得到1H-吡咯并[2,3-b]吡啶-4-胺[4]。然后将其置于Balz-Schiemann反应条件下[5],热解得到氟化芳香族化合物(方案1)。
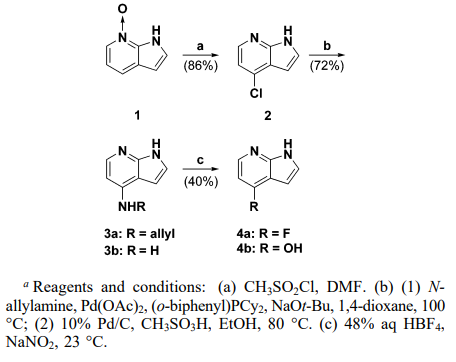
方案1.通过Balz-Schiemann反应合成含氟氮杂吲哚
上述Balz-Schiemann路线提供了一个四步合成4-氟-1H-吡咯并[2,3-b]吡啶的方法。
第二种方法尝试将离去基团从氯化物改变为溴化物,在锂卤素交换反应中使用溴化物,然后用亲电氟试剂处理,生成4-氟-1H-吡咯并[2,3-b]吡啶[6](方案2)。
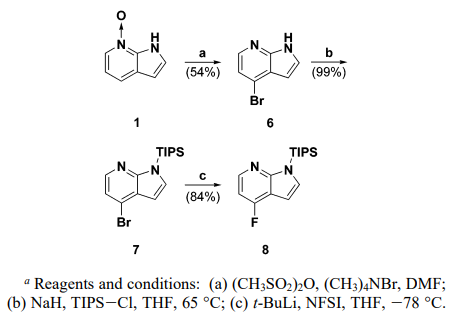
方案2. 通过亲电氟化反应合成含氟氮杂吲哚
在DMF中用甲磺酸酐和溴化四甲基铵处理N-氧化物得到4-溴-1H-吡咯并[2,3-b]吡啶,然后其被保护为N-三异丙基硅基衍生物。在-78°C的THF中使用叔丁基锂进行溴化物的锂-卤素交换[7],然后添加N-氟代双苯磺酰胺得到4-氟-1H-吡咯并[2,3-b]吡啶[8]。
总之,以上两种合成4-氟-1H-吡咯并[2,3-b]吡啶的路线:第一种合成方法的特点是在室温下进行Balz-Schiemann反应。第二种方法的特点是相应的溴化物的有效锂-卤素交换,然后用亲电氟源淬灭。
应用
含氟氮杂吲哚衍生物,特别是含氟氮杂吲哚已被公认为是生物过程调节、药物化学和药物发现计划中的优异结构。它们的商业可用性稳步增加,合成创新也在不断更新。一些含氟氮杂吲哚衍生物已经从药物化学项目中崭露头角,其中一些已经也已经发展成为治疗人类疾病的候选药物分子。
参考文献
1. (a) Meade, E. A.; Beauchamp, L. M. J. Heterocycl. Chem. 1996, 33,303. (b) Antonini, I.; Claudi, F.; Cristalli, G.; Franchetti, P.; Grifantini,M.; Martelli, S. J. Med. Chem. 1982, 25, 1258. (c) Schneller, S. W.; Luo,J.-K. J. Org. Chem. 1980, 45, 4045.
2. Benoıˆt, S.; Gingras, S. Processes for the preparation of antiviral 7-azaindole derivatives. U.S. Provisional Patent 60/367,401, 2003.
3. Wolfe, J. P.; Tomori, H.; Sadighi, J. P.; Yin, J.; Buchwald, S. L. J.Org. Chem. 2000, 65, 1158.
4. (a) Jaime-Figueroa, S.; Liu, Y.; Muchowski, J. M.; Putman, D. G.Tetrahetron Lett. 1998, 39, 1313. Other deallylation conditions attempted did not improve yield; see other conditions in ref 9a and: (b) Garro-Helion,F.; Merzouk, A.; Guibe´, F. J. Org. Chem. 1993, 58, 6109.
5. On a larger scale, purification could also be done using Dowex 50W X 4 resin.
6. Differding, E.; Ofner, H. Synlett 1991, 187.
7. A >1.5 M solution of tert-butyllithium in pentane was used to avoid the precipitation of N-fluorobenzenesulfimide.
8. Barnes, K. D.;Hu, Y.; Hunt, D. A. Synth. Commun. 1994, 24, 1749.
