
期刊:Arthritis and Rheumatology
影响因子:13.3
伯豪技术服务:时空组学
研究背景
类风湿关节炎(rheumatoid arthritis, RA)是一类自身免疫性疾病,其主要以多关节滑膜炎、血管翳形成以及软骨与骨侵蚀为主要病理表现。生物制剂(bDMARDs)的应用让大部分RA患者受益,但是仍然有30%-40%的患者对多种bDMARDs反应较差,揭示了RA中存在潜在的且未被重视的通路和靶点,以及对这些通路和靶点进行深入探索的必要性。与长期处于缓解期的RA患者相比,活动期的RA患者关节破坏的风险和进程明显增加。因此,解析RA患者关节局部免疫微环境在活动期和缓解期的差异性,探索关节破坏的发生过程,对于保护RA患者的关节至关重要。
研究技术
ScRNA-SEQ,ST
研究内容
结合单细胞 RNA 测序 (scRNA-seq) 和空间转录组学,本研究对来自 3 名复发 RA 患者和 3 名缓解期患者的 6 个匹配的滑膜组织样本进行了测序。使用 scRNA-seq 鉴定内衬和亚衬 FLS 子集;分析了复发期和缓解期之间 FLS 子集转录组的差异。差异分析表明,复发性 RA 患者的内膜 FLS 中成纤维细胞生长因子 (FGF) 通路高度激活,mIHC 证实 FGF10 表达增加。虽然 I 型干扰素通路也在内层 FLS 中被激活,但体外刺激实验表明它独立于 FGF10 通路。FLS 中 siRNA 敲低 FGF10 显着降低 RANKL 的表达。此外,重组 FGF10 蛋白增强了原代人源血管翳细胞培养物中的骨侵蚀,而 FGFR1 抑制剂则减弱了这一过程。最后,施用 FGFR1 抑制剂在 CIA 大鼠模型中显示出治疗效果。
技术路线图
研究结果
1. 综合 scRNA-seq 和 ST 分析揭示复发和持续缓解 RA 滑膜的时空景观
为了研究复发和持续缓解 RA 的潜在病理机制,对来自三名复发 RA 患者和三名持续缓解 RA 患者的 6 个滑膜样本进行了 scRNA-seq,并对 8 个配对样本(复发 RA 中的 2 个血管翳样本和 3 个滑膜样本以及持续缓解 RA 中的 3 个滑膜样本)进行了ST测序。经过数据预处理和严格的 scRNA-seq 数据质量控制后,获得了来自复发 RA 患者 (n=3) 的 22,925 个细胞和来自持续缓解 RA 患者 (n=3) 的 32,236 个细胞用于进一步分析。首先进行了聚类分析,确定了 25 个簇,包括成纤维细胞(6 个簇)、内皮细胞(4 个簇)、骨髓细胞(5 个簇)、自然杀伤(NK)细胞(2 个簇)、肥大细胞(1 个簇)、B 细胞 (4个簇)、CD8+ T 细胞、CD4+ T 细胞和使用已建立的细胞标记基因的增殖细胞(图 1B)。在滑膜细胞分数中观察到复发组和缓解组之间的显着差异。我们发现复发性 RA 中的 CD55+ 衬里成纤维细胞 (FB L-CD55)、T 细胞和 NK 细胞比缓解期的 RA 中高度富集(图 1C )。同时分析了八个样品的 ST 数据。我们使用无人监督的集群来分析血管翳和滑膜,并按细胞类型进行注释(图 1D)。我们发现位于血管翳内层的 CD55+ 内层成纤维细胞数量丰富(图 1E)。

图1
2. 复发和缓解 RA 的 FLS 子集显示出不同的激活途径
鉴于 FLS 在 RA 发病机制中的关键作用,研究特别关注 FLS 亚群在 RA 复发和缓解中的作用。经过质量控制,获得了 22,679 个高质量的 FLS,根据差异表达基因 (DEG) 将其分为四个子集:CD55+ 衬里成纤维细胞 (FB L-CD55)、CXCL12+ 亚衬成纤维细胞 (FB S-CXCL12)(图 2A 和 C) 、MFAP5+ 亚衬成纤维细胞 (FB S-MFAP5) 和 VEGFA+ 亚衬成纤维细胞 (FB S-VEGFA)(图 2A)。通过整合单细胞测序数据和公共数据库的数据,观察到复发性 RA 中 CD55+ 内衬成纤维细胞的比例很高,这表明内膜成纤维细胞在复发 RA 中显着增殖(图 2B)。通过对DEG 进行聚类来生成热图,以深入了解复发和缓解 RA 中 FLS 的四个子集的分子特征差异(图 2D)。发现 FB L-CD55 和 FB S-CXCL12 在复发和缓解 RA 之间存在显着差异。FB L-CD55 表达与基质金属蛋白酶 (MMP) 和脂多糖结合蛋白 (LBP) 相关的基因, MMP加速软骨降解, LBP表明复发 RA 中先天免疫反应的上调(图 2D)。FB S-CXCL12 在复发性 RA 中表达与 MHC II 类呈递和补体激活途径 (C3) 相关的基因(图 2D)。接下来,研究基于 Hallmark 和 Reactome 数据集对 FLS 子集进行了通路分析(图 2E)。发现,来自复发性 RA 的 FB L-CD55 中的干扰素 α (IFN-α)、干扰素 γ (IFN-γ) 和成纤维细胞生长因子受体 1 (FGFR1) 通路高度激活。在缓解期 RA 中,FB L-CD55 和 VEGFA+ 成纤维细胞 (FB S-VEGFA) 中高度富集凋亡和缺氧途径。这些数据表明,FLS 亚群具有不同的基因表达模式,受不同的复发和缓解 RA 途径调节。

图2
3. FGF10-FGFR1信号通路在复发性RA的内层FLS中异常激活
CellChat 分析显示,FB L-CD55 与复发 RA 中的其他 FLS 子集具有强烈的 FGF 信号通路相互作用(图 3A)。此外,研究观察到 FGF10-FGFR1 对在复发 RA 的 FB L-CD55 中高度激活(图 3B,左)。对于亚衬FLS,FGF7-FGFR1 对占主导地位;然而,复发和缓解 RA 之间没有明显差异(图 3B,右)。对不同 FLS 亚群中 FGF7、FGF10 和 FGF14 转录组表达水平的进一步分析表明,FGF10 在复发 RA 的 FB L-CD55 细胞中高表达(图 3C)。使用 mIHC,研究确认 PDPN+FGF10+ FLS 主要在复发 RA 的血管翳内层中检测到(图 3D)。通过 IHC 对复发和缓解 RA 患者的 12 个血管翳样本中的 FGF10 表达进行定量分析显示,复发 RA 患者中 FGF10 阳性区域的比例显着高于缓解 RA 患者(图 3E 和 F)。通过结合 scRNAseq 和 IHC 数据,证明了复发 RA 内膜 FLS 中 FGF10-FGFR1 信号通路的过度激活。
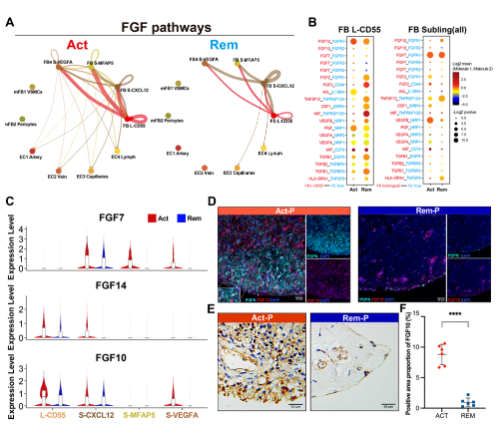
图3
4. IFN-α和FGFR1信号通路在复发性RA中很大程度上是独立的
鉴于 IFN-α 和 FGFR1 信号通路主要在复发 RA 的内层 FLS 中激活,本研究探讨了这两种通路之间是否存在交叉调节。首先,通过比较来自 scRNA-seq 数据的 FLS 中的两个通路评分来进行相关性研究。未观察到 IFN-α 和 FGFR1 信号通路与总 FLS 或复发或缓解 RA 的 FLS 之间存在任何已建立的相关性 (R>0.3)(图 4A 和 B)。这些结果表明这两条途径在单细胞水平上很大程度上是独立的。
为了证实这些发现,进行了体外刺激实验。用重组人干扰素α2a(IFN-α2a)或FGF10蛋白刺激MH7A FLS细胞系6小时,并通过qRT-PCR测量目标分子。与未刺激的对照组相比,IFN-α2a刺激MH7A FLS细胞系以剂量依赖性方式诱导了预期的IFI6和ISG15 mRNA表达;然而,没有观察到 FGF10 mRNA 的显着变化(图 4C)。同时,用 10 ng/ml 和 100 ng/ml FGF10 刺激 MH7A FLS 细胞系对 IFI6 和 ISG15 mRNA 的表达几乎没有影响(图 4D)。总的来说,本研究提供了初步证据表明 IFN-α 和 FGFR1 信号通路不太可能相互交叉调节。
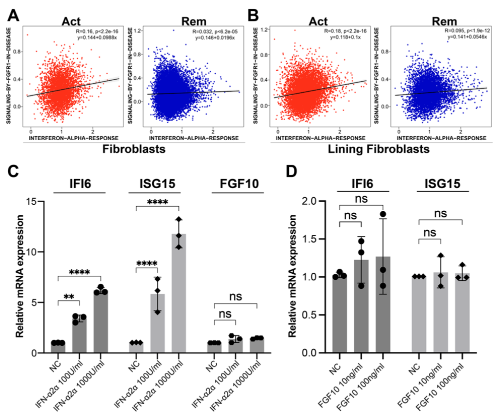
图4
5. 衬里 FLS 中的 IFN-α 和 FGFR1 信号通路与复发 RA 中的不同代谢通路存在差异相关
既往对RA和OA滑膜成纤维细胞代谢的研究表明,缺氧和糖酵解是RA滑膜成纤维细胞的特征。研究观察到复发和缓解 RA 中的 FLS 亚群表现出不同的代谢活动(图 5A)。在衬里成纤维细胞(FB L-CD55)中高度富集的代谢途径中,花生四烯酸代谢、亚油酸代谢、氧化磷酸化、泛酸和CoA生物合成在复发性RA中占主导地位。相比之下,烟酸盐和烟酰胺代谢、半胱氨酸和蛋氨酸代谢以及糖酵解/糖异生在 RA 缓解中普遍存在。
相关分析显示,IFN-α信号通路与亚油酸、α-亚麻酸和花生四烯酸代谢密切相关(图5B和C)。相反,FGFR1信号通路与代谢通路的相关性较小,与赖氨酸降解和粘蛋白型O-聚糖生物合成的相关性较弱(图5B和D)。这些数据表明 IFN-α 和 FGFR1 信号通路与复发性 RA 衬里 FLS 中的不同代谢通路相关。
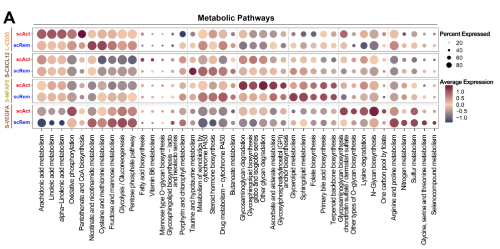

图5
6. 阻断 FGFR1 信号通路可减轻体外骨侵蚀,并在大鼠关节炎模型中显示治疗效果
研究进行 Transwell 侵袭实验来探讨 FGF10/FGFR1 信号在 FLS 侵袭性中的潜在作用。与siNC和siFGF7相比,siFGF10显着抑制FLS的侵袭能力(图6A和B)。通过蛋白质印迹进一步测量了与 FLS 侵袭性相关的几种基质金属蛋白酶 (MMP)。结果显示,与siFGF7和siNC相比,siFGF10显著抑制MMP2的表达(图6C和D)。基于此,假设 FGF10/FGFR1 信号传导促进复发性 RA 中 FLS 的侵袭性,并且 MMP2 参与了这一过程。除了MMP2之外,发现与siFGF7和siNC相比,siFGF10强烈抑制RANKL的表达(图6C和D),这表明FGF10/FGFR1途径可能参与复发性RA的破骨细胞生成。
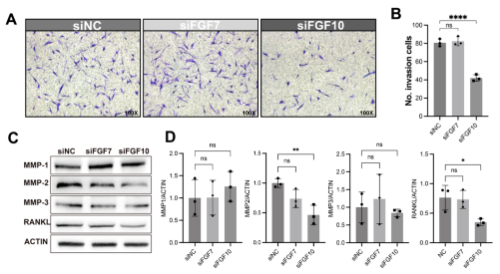
图6
参考文献:
X h Meng, Z ch Chen, T Li , et al. Role and Therapeutic Potential for Targeting Fibroblast Growth Factor 10/FGFR1 in Relapsed Rheumatoid Arthritis[J]. Arthritis Rheumatol,2023.
