
编者按
由于广泛的组织损伤和修复不足,人类脊髓损伤(SCI)可导致感觉和运动功能永久性丧失。然而,面对机体免疫系统过度反应所引起的炎症,患者的治疗或许会表现为效率低下,而免疫系统通常能保护机体抵御感染;通过抑制整个机体免疫反应来减少炎症的药物或许也能抑制促进机体修复的免疫细胞。
今天我们来分享一篇2023年由爱丁堡大学科学家们发表在国际杂志Theranostics上,题为“Drug screening in zebrafish larvae reveals inflammation-related modulatorsof secondary damage after spinal cord injury in mice”的研究文章中,这项研究测试了1000多种能改善脊髓损伤恢复的潜在药物,并发现了一种非常有希望的新型疗法途径。
文章题目
Drug screening in zebrafish larvae reveals inflammation-related modulatorsof secondary damage after spinal cord injury in mice
杂志:《Theranostics》
影响因子:IF=12.400
发表时间:2023年第13卷第8期
翻译:黄燕峰
作者:Catherina G. Becker等
单位:爱丁堡大学
01、研究背景
由于广泛的组织损伤和修复不足,人类脊髓损伤(SCI)可导致感觉和运动功能永久性丧失。原发性组织损伤是由撞击直接造成的,而继发性损伤则是由于血脊髓屏障的破坏而导致更广泛区域发生的继发性损伤。这通常伴有慢性炎症。
虽然免疫反应可以对组织修复产生有益的影响,但它也可以加剧组织损伤,具体取决于免疫细胞的表型或激活状态。脊髓损伤后,免疫细胞在很大程度上表现出促炎状态,包括释放 IL-1β,这会对哺乳动物和斑马鱼脊髓损伤后的恢复产生负面影响。这种主要由巨噬细胞和小胶质细胞组成的极化通常被称为 M1(促炎症)或 M2(促再生),在体内观察到许多混合激活状态。
研究者使用il-1β荧光斑马鱼系来筛选一组潜在有益的脊髓损伤免疫调节剂药物。研究发现组胺受体2b拮抗剂西米替丁抑制il-1β在斑马鱼幼鱼中的表达,并部分恢复irf8斑马鱼慢性炎症突变模型中受损的再生。重要的是,在中度脊髓挫伤小鼠模型中,该药物调节了免疫反应,导致显著的组织保留和改善功能恢复。这项研究强调了斑马鱼脊髓损伤模型在快速筛选药物库以寻找治疗目前没有有效治疗方法的哺乳动物脊髓损伤的潜在疗法的有用性。
02、主要研究结果
1、斑马鱼幼虫脊髓损伤的筛查,揭示了西米替丁作为病变引起的炎症的调节剂
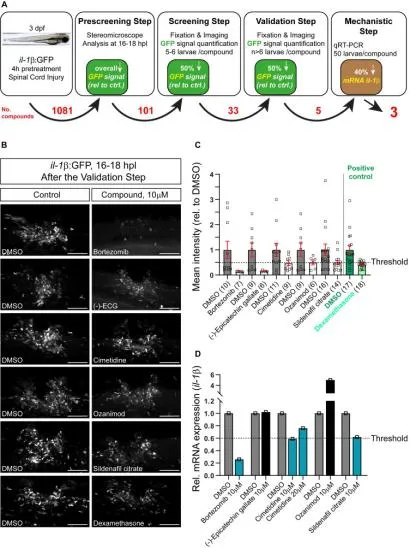
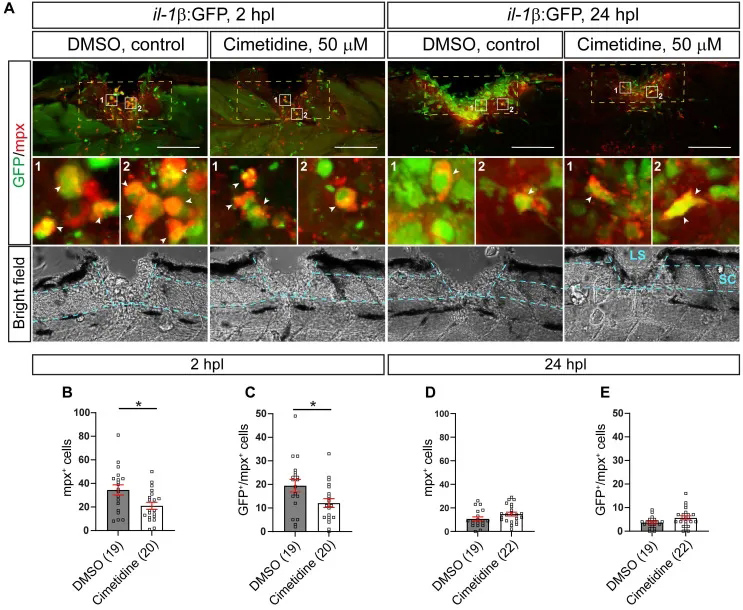
研究者利用il-1β表达荧光斑马鱼在不同化合物中预孵育4h,然后用相同的化合物对脊髓进行人工损伤和损伤后处理。
通过筛选,最终三种化合物被发现可以将内源性il-1β mRNA的表达降低至少40%。按照疗效排序,这些药物分别是硼替佐米、西米替丁和柠檬酸西地那非。对前三种化合物的独立重新测试证实了硼替佐米和西米替丁对il-1β mRNA水平的具有影响,但西地那非对il-1β mRNA水平没有影响(图S1A-C)。通过筛选研究者发现浓度在 10 至 50 µM 之间的西米替丁对于减少 mRNA 也同样有效(图1D) 或il-1β报告基因表达情况。
2、西米替丁降低中性粒细胞对损伤的反应
研究者使用免疫组织化学方法分析了Mpx在il-1β:GFP细胞系(标记表达il-1β的中性粒细胞)中的中性粒细胞反应。研究者通过统计中性粒细胞数量以及巨噬细胞数量,进一步加强了西米替丁具有抗炎作用的观点。
3、西米替丁改善再生缺陷突变斑马鱼长时间炎症的恢复
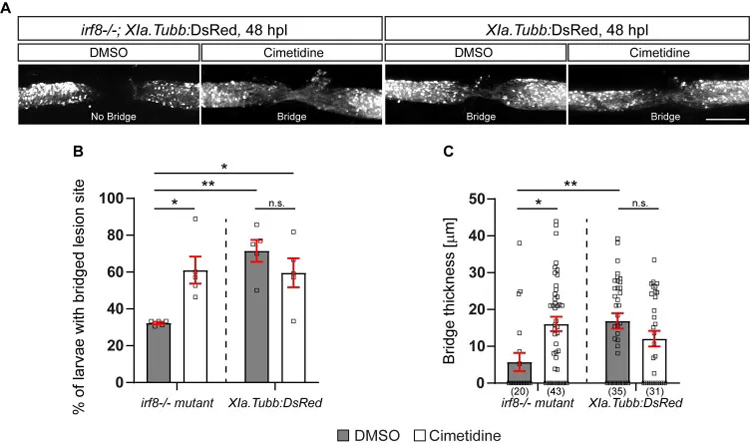
研究者认为西米替丁应该能够改善斑马鱼长期炎症模型的再生结果。为了评估损伤后的解剖恢复情况,研究者将所有神经元组织标记到irf8突变系中。
研究者重现了先前报道的与野生型幼虫相比,irf8突变体的解剖恢复减少。用西米替丁孵育可显著增加损伤部位桥接的irf8突变体的比例,但对野生型动物无显著影响。通过测量轴突桥的厚度,证实了西米替丁对irf8突变体幼虫轴突再生的部分恢复作用。这表明西米替丁可以改善长时间炎症突变体的轴突再生,并且对野生型动物的再生没有影响。
4、西米替丁通过hrh2b起作用
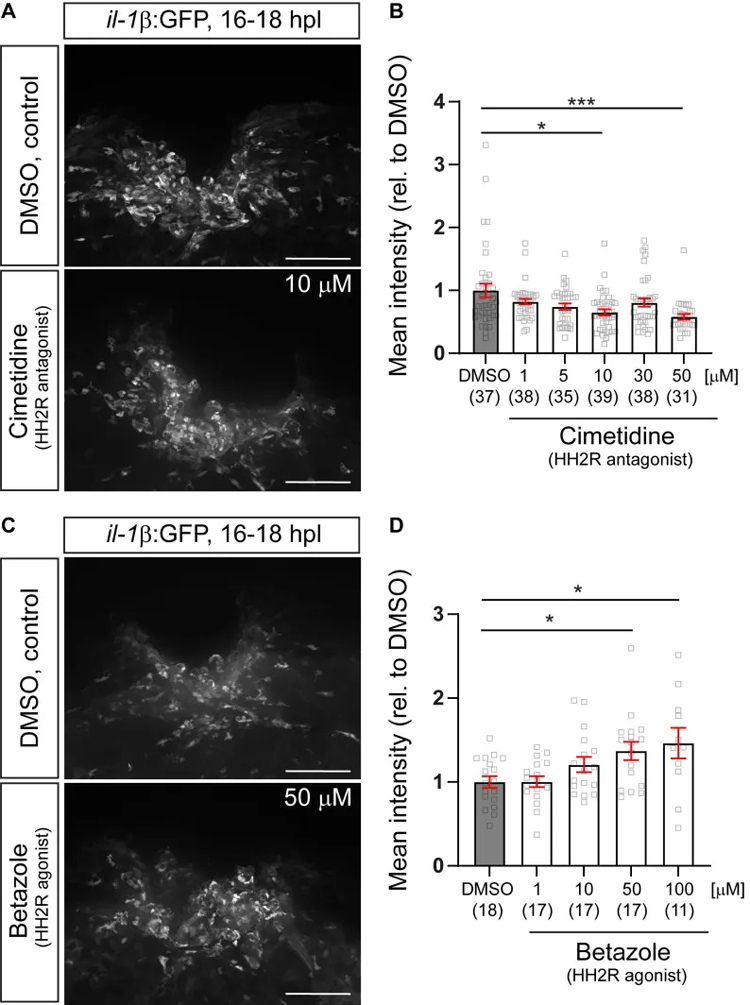
为了确定本研究观察到的西米替丁的作用机制是否通过靶向调节HRH2受体信号介导。研究者首先分析了il-1β荧光鱼中,西米替丁与GFP荧光之间的剂量效应关系,以及特异性HRH2激动剂与GFP荧光之间的剂量效应关系。正如预期的那样,西米替丁治疗导致荧光呈剂量依赖性降低,而倍唑则导致GFP荧光呈剂量依赖性增加。这表明Hrh2受体对脊髓损伤后il-1β表达水平有积极作用。
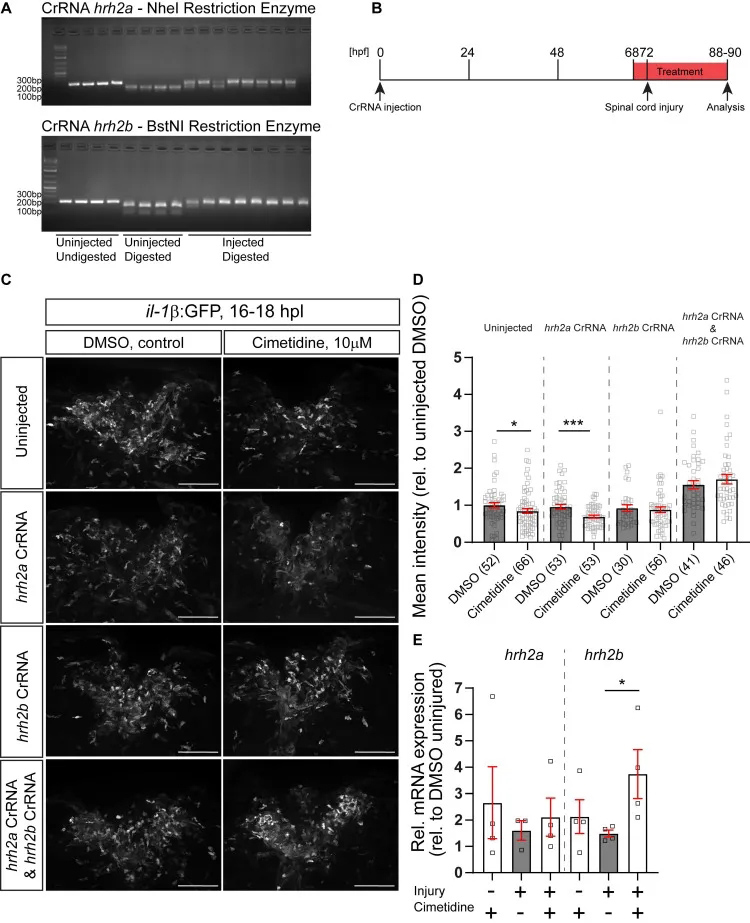
为了确定这些基因(hrh2a和hrh2b)中哪一个对西米替丁对il-1β表达水平的作用起作用。研究者测试了西米替丁对脊髓损伤后hrh2a和hrh2b体细胞突变体的作用,这些突变体是在il-1β:GFP报告系的背景下基因编辑的。hrh2b的体细胞突变不影响幼虫的整体发育或轴突桥接恢复,游泳行为也显示未受损的恢复。hrh2a和hrh2b的双突变对游泳的恢复也没有影响,说明hrh2a不能弥补hrh2b的缺失。同样,用西米替丁阻断Hrh2受体也不会损害游泳功能的恢复。在以hrh2a为靶点的动物中,西米替丁在il-1β:GFP报告鱼损伤后仍然能够降低GFP荧光。
研究者通过qRT-PCR评估了西米替丁对脊髓损伤部位hrh2a mRNA和hrh2b mRNA的表达水平。研究者可以检测到这两种受体在对照组和病变动物。西米替丁治疗后,hrh2b mRNA的相对表达水平在受损动物中升高,而hrh2a mRNA的相对表达水平没有升高,而在未受损动物中没有升高。总之,这些实验支持西米替丁对il-1β表达的作用依赖于hrh2b受体的存在。
5、脊髓损伤增加小鼠脊髓损伤后HDC和H2受体染色的表达
通过免疫荧光染色确定,研究者在未损伤小鼠脊髓背角检测到极弱的组胺脱羧酶(HDC)标记。脊髓损伤后48小时,背角神经元的HDC标记明显增加,西米替丁治疗后这种增加明显减少。脊髓损伤48小时后,脊髓背角浅层和脊髓腹外侧区血管中HRH2染色显著增加。经西米替丁处理后,HRH2染色升高的程度降至对照水平。
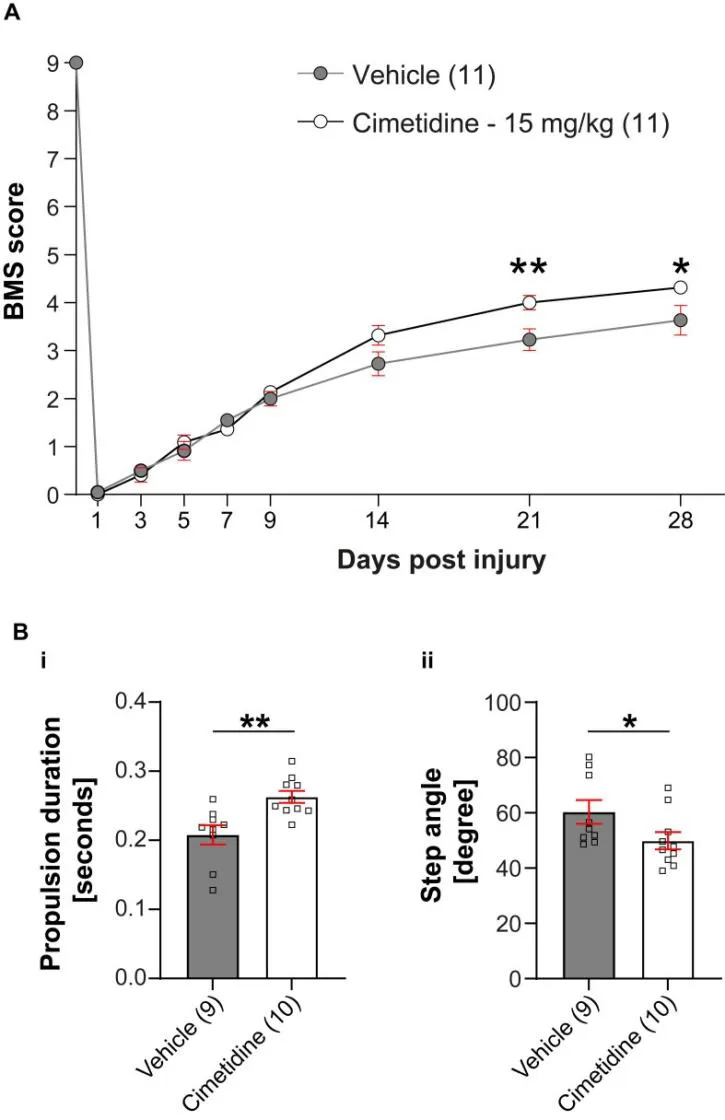
6、西米替丁促进小鼠脊髓损伤后运动恢复和减轻小鼠脊髓损伤后的继发性损伤
考虑到斑马鱼irf8突变体的恢复改善,研究者评估药物对脊髓损伤小鼠模型恢复的影响。研究者对成年雌性进行深度麻醉和中度挫伤,然后评估运动恢复。西米替丁治疗小鼠损伤后21天开始运动恢复有显著改善。分析显示,西米替丁治疗增加了推进时间,减小了步距角。
研究者评估了西米替丁对各种组织学指标的影响。通过对28天评估损伤大小、髓磷脂损失、神经元损失和血清素能神经支配密度评估,所有的组织学参数都显示西甲替丁治疗的脊柱组织有显著的改善。
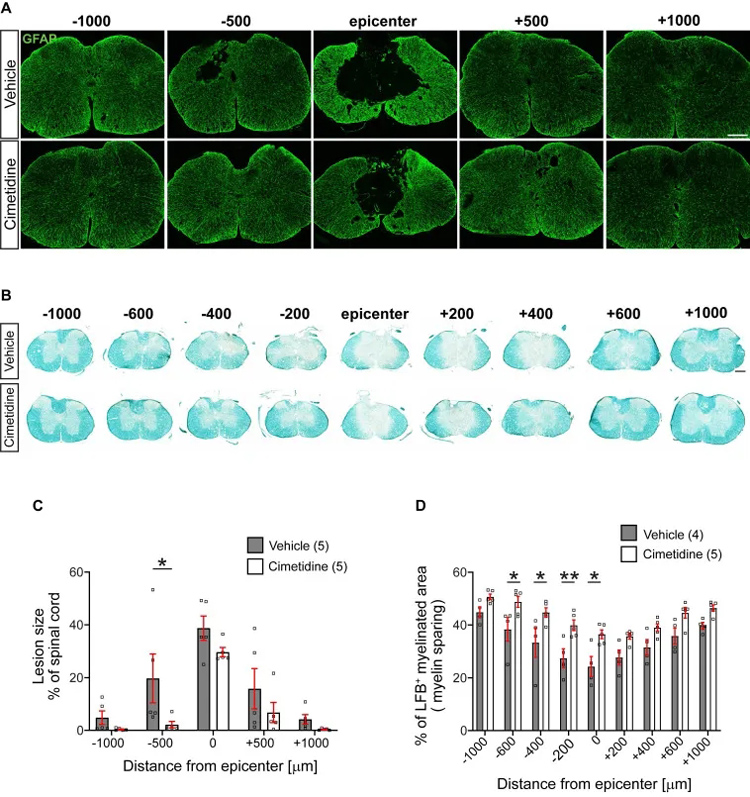
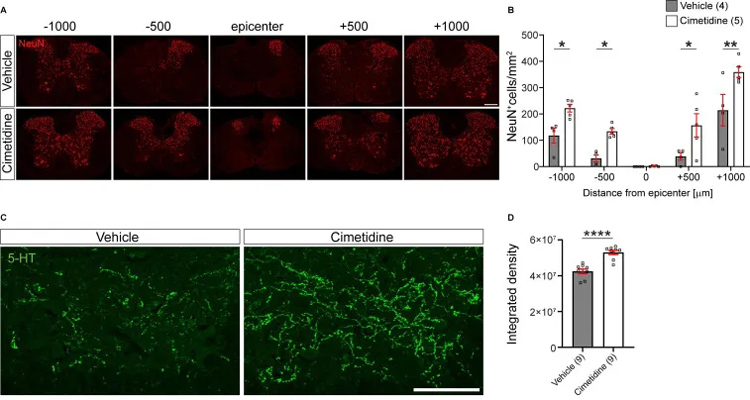
7、西米替丁促进小鼠脊髓损伤后运动恢复和减轻小鼠脊髓损伤后的继发性损伤
研究者通过qRT-PCR评估IL-1β mRNA水平。西米替丁治疗显著降低了斑马鱼中il-1β的表达。研究者还通过免疫荧光染色在蛋白水平上评估IL-1β表达的变化。在未损伤的脊髓中几乎检测不到IL-1β的免疫标记,但在脊髓损伤后48小时显著增加。
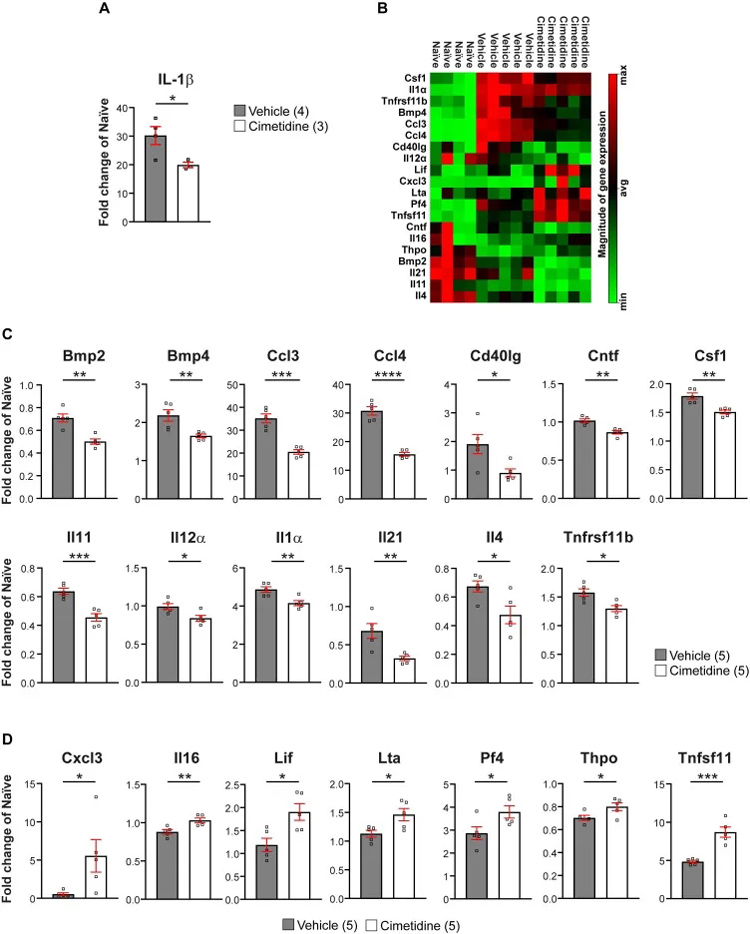
接下来,评估了脊髓损伤后更长时间的西米替丁治疗10天是否会更广泛地调节小鼠损伤后的免疫反应。总的来说,结果表明西米替丁改变脊髓损伤后的炎症反应,使其更有利于再生。随后,评估了西米替丁治疗是否会影响炎症细胞的浸润和活化。
研究者发现,在脊髓损伤后4周,西米替丁治疗减少了病变部位CD11b+巨噬细胞/小胶质细胞的数量和CD11b染色的程度。与对照组相比,西米替丁治疗减少了损伤中心的脂质过氧化这些结果进一步证明西米替丁可以减轻小鼠脊髓损伤后的炎症和脂质过氧化。
03、编者点评
综上,本研究表明通过斑马鱼幼体的药物筛选试验,组胺 H2 受体拮抗剂西米替丁可作为脊髓损伤后的免疫调节剂。西咪替丁可调节斑马鱼和小鼠的免疫反应,并促进斑马鱼模型和脊髓损伤后成年小鼠的恢复。小鼠功能恢复的增加伴随着更广泛的神经组织的保存。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型及多种类器官培养平台,欢迎有需要的读者垂询!
参考文献
[1]Dumont RJ, Okonkwo DO, Verma S, Hurlbert RJ, Boulos PT, Ellegala DB. et al. Acute spinal cord injury, part I: pathophysiologic mechanisms. Clin Neuropharmacol. 2001;24:254–64.
[2]McDonald JW, Sadowsky C. Spinal-cord injury. Lancet. 2002;359:417–25.
[3]Sekhon LH, Fehlings MG. Epidemiology, demographics, and pathophysiology of acute spinal cord injury. Spine (Phila Pa 1976) 2001;26:S2–12. [PubMed] [Google Scholar
[4]Greenhalgh AD, David S, Bennett FC. Immune cell regulation of glia during CNS injury and disease. Nat Rev Neurosci. 2020;21:139–52. [PubMed] [Google Scholar]
[5]Chio JCT, Xu KJ, Popovich P, David S, Fehlings MG. Neuroimmunological therapies for treating spinal cord injury: Evidence and future perspectives. Exp Neurol. 2021;341:113704.
[6]Boato F, Rosenberger K, Nelissen S, Geboes L, Peters EM, Nitsch R. et al. Absence of IL-1beta positively affects neurological outcome, lesion development and axonal plasticity after spinal cord injury. J Neuroinflammation. 2013;10:6.
[7]Kroner A, Greenhalgh AD, Zarruk JG, Passos Dos Santos R, Gaestel M, David S. TNF and increased intracellular iron alter macrophage polarization to a detrimental M1 phenotype in the injured spinal cord. Neuron. 2014;83:1098–116.
[8]Tsarouchas TM, Wehner D, Cavone L, Munir T, Keatinge M, Lambertus M. et al. Dynamic control of proinflammatory cytokines Il-1β and Tnf-α by macrophages in zebrafish spinal cord regeneration. Nat Commun. 2018;9:4670.
[9]Paolicelli RC, Sierra A, Stevens B, Tremblay ME, Aguzzi A, Ajami B. et al. Microglia states and nomenclature: A field at its crossroads. Neuron. 2022;110:3458–83.
