RNAi技术作为基因敲减的重要手段,已被广泛用于探索基因功能、细胞信号转导通路分析和药物设计及开发等领域。在RNA干扰实验中,shRNA的持续性表达通常借助于聚合酶III型启动子驱动。常见的聚合酶III型启动子包括U6和H1,这类启动子主要用来启动比较短的RNA,可以调控shRNA的高水平表达实现基因沉默,但是由于缺少组织特异性,无法满足对特定组织中基因表达调控的需求。miRNA具有与shRNA相似的成熟机制,因此可以用miRNA的结构(目前miR-30较为常用)来表达,采用聚合酶II型启动子驱动,不仅可以启动较大的基因转录,还能实现RNA干扰的高效组织特异性表达!
01
miRNA的细胞加工机制
miRNA的成熟机制与shRNA类似,只是多了一步核内加工的过程。miRNA在细胞核内先由RNA聚合酶II转录miRNA gene生成较长的初级miRNA(pri-miRNA),并被Drosha酶加工成60-70nt的具有发夹结构的RNA,即前体miRNA(pre-miRNA),随后在Exportin-5复合物的帮助下转运出胞核。在胞浆中由Dicer酶剪切为成熟的miRNA,随即被整合进RISC中,通过与mRNA完全或不完全配对来调节基因表达。miRNA与mRNA的识别位点主要位于3‘UTR区,不完全的碱基配对主要引起mRNA翻译抑制,完全或接近完全的碱基配对则对mRNA进行切割。
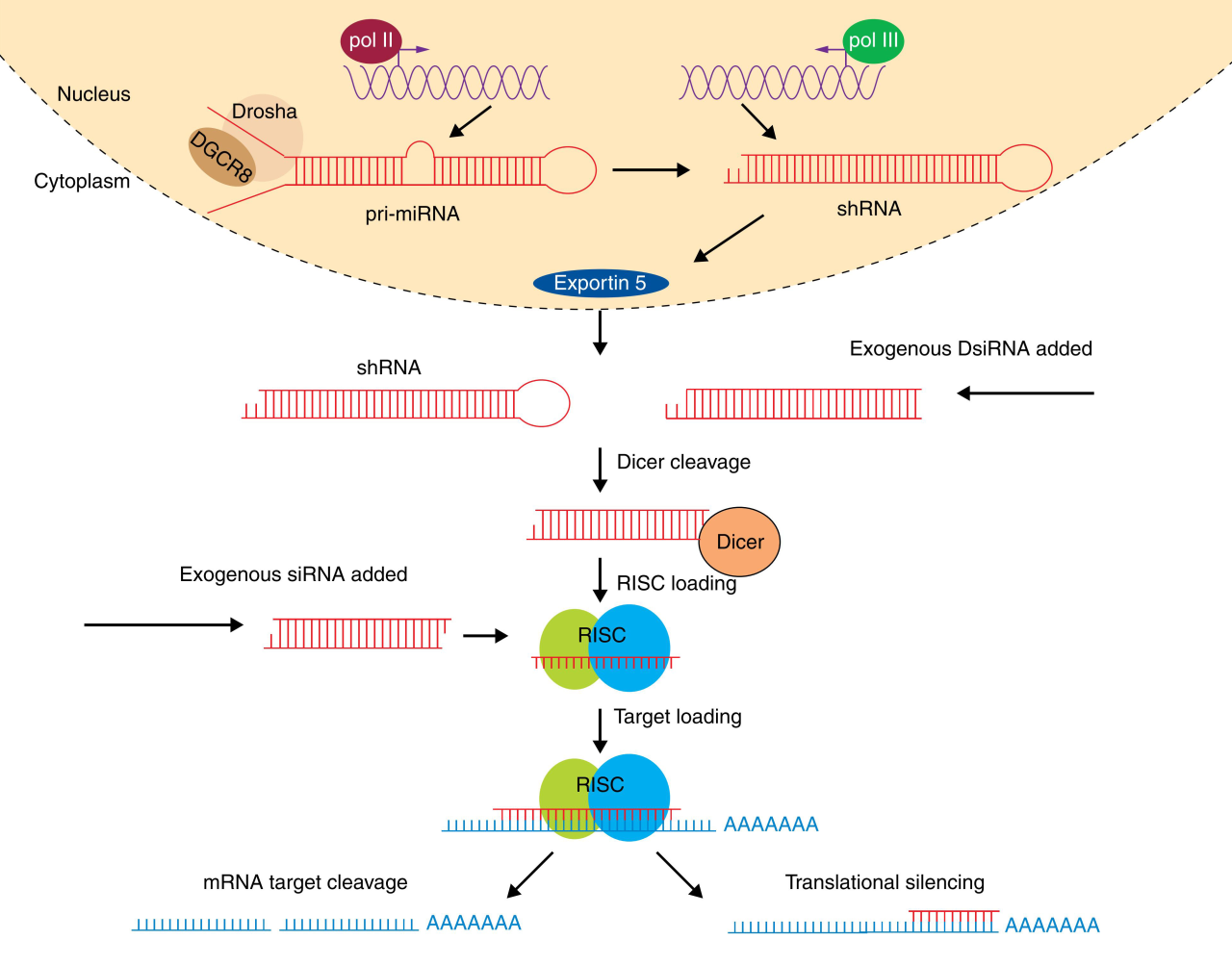
(Bobbin ML, Burnett JC, Rossi JJ. Genome Med. 2015.)
02
基于miR-30结构的shRNA设计方案
设计前先选择合适的启动子,并将miR-30的5'flanking region和3'flanking region序列保留,然后将其成熟区域的序列替换成靶点序列。结构示意图如下:
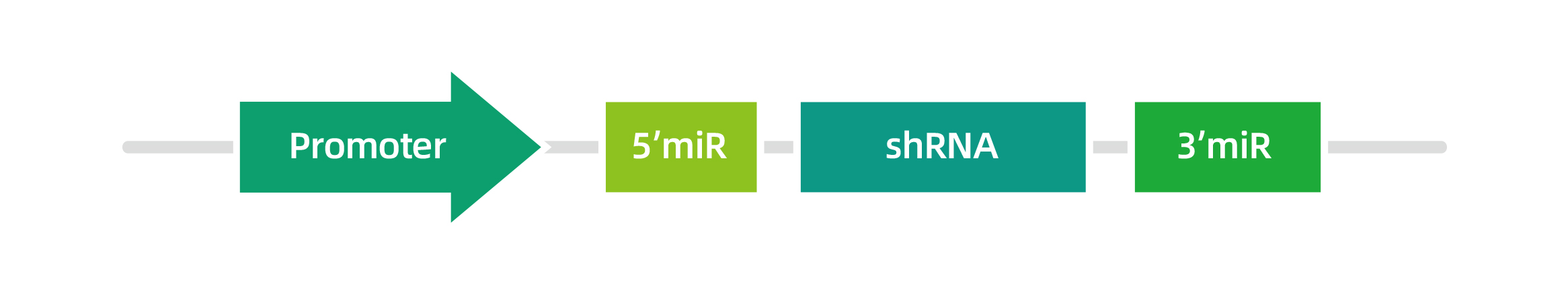
shRNAmir-30设计原则:
shRNAmir-30在结构上高度类似shRNA,其设计原则可以参考shRNA,但需注意两点:
1) 进行shRNAmir-30结构设计时一般选择22 bp的靶序列;
2) 基于miR-30的shRNA在shRNA茎基部存在一个凸起,因此在进行正义链设计时,需作以下修改:碱基首位为C/G,则改为A;碱基首位为T/A,则改为C,使最终折叠的RNA中产生适当的凸起。
03
基于miR-30结构的shRNA优势
1) 启动子选择性多:基于miR-30的shRNA可以通过多种RNA聚合酶II启动子转录,包括广谱启动子(CMV、CAG和EF1a等)、组织特异性(hSyn、TBG和cTnT等)或诱导型启动子(四环素启动子TRE)。
2) 实现多个shRNA共表达:由于RNA聚合酶II可以启动较大的基因转录,因此多个shRNAmiRs可以作为多顺反子由单个启动子驱动表达。
3) 可与报告基因共表达:将报告基因与shRNAmiRs作为多顺反子一起共表达,实现shRNA的转录监测。
04
维真mir30-based shRNA服务及案例
维真生物可以根据客户的实验需求,将选定启动子和shRNA序列构建至mir30-based shRNA载体上,并能提供序列筛选服务,助力筛选出干扰效果更好的shRNAmir-30,此外,我们还可进行后续慢病毒、腺病毒和腺相关病毒的包装,实现组织特异性基因沉默,是您的理想选择!公司有几十种组织特异性启动子可供选择,涵盖神经、肝脏、心脏、眼睛、胰腺、肾脏、血管及肌肉等组织。
下面是几个维真客户案例分享:
案例1- 神经
文章标题:
Stress-Induced Metabolic Disorder in Peripheral CD4+T Cells Leads to Anxiety-like Behavior
发表期刊:
Cell (IF 66.85)
合作客户:
浙江大学靳津教授、东南大学柴人杰教授研究团队
|
基因信息 |
mAdora1:小鼠腺苷A1受体 |
|
病毒产品 |
AAV9-GFAP-GFP-miR30-shRNA(mAdora1) AAV8-MBP-GFP-miR30-shRNA(mAdora1) AAV8-MBP-GFP-miR30-shRNA(scramble) |
|
病毒用量 |
1E+11 vg/mouse |
|
注射部位 |
左杏仁核 |
|
注射方式 |
脑立体定位注射 |
案例2- 神经
文章标题:
Targeting PDK2 rescues stress-induced impaired brain energy metabolism
发表期刊:
Molecular Psychiatry (IF 13.437)
合作客户:
山东第一医科大学附属济宁第一人民医院江沛教授研究团队
|
基因信息 |
GR:糖皮质激素受体 PDK2:丙酮酸脱氢酶激酶2 |
|
病毒产品 |
AAV9-hSyn-shGR AAV9-hSyn-shPDK2 AAV9-hSyn-shNC |
|
病毒用量 |
1 µL |
|
注射部位 |
额叶皮层 |
|
注射方式 |
脑立体定位注射, 0.25 μL/min |
案例3- 肝脏
文章标题:
PLK1 (polo like kinase 1)-dependent autophagyfacilitates gefitinib-induced hepatotoxicity by degrading COX6A1 (cytochrome c oxidase subunit 6A1)
发表期刊:
Autophagy(IF 13.391)
合作客户:
浙江大学何俏军/杨波教授研究团队
|
基因信息 |
PLK1,Polo样激酶1 |
|
实验动物 |
C57BL/6小鼠 |
|
病毒产品 |
AAV8-ALB-shPLK1 AAV8-control |
|
病毒用量 |
4×10E11 vg/mouse |
|
注射方式 |
尾静脉注射 |
案例4- 肝脏
文章标题:
Hepatic DDAH1 mitigates hepatic steatosis and insulin resistance in obese mice:Involvement of reduced S100A11 expression
发表期刊:
ACTA PHARM SIN B(IF14.903)
合作客户:
中国科学院大学陆忠兵教授研究团队
|
基因信息 |
S100a11:S100钙结合蛋白A11 |
|
实验动物 |
HFD喂养的Ddah1f/f Ddah1HKO小鼠 |
|
病毒产品 |
AAV8-TBG-shS100a11 AAV8-GFP |
|
病毒用量 |
1.1×10E12 vg/mouse |
|
注射方式 |
尾静脉注射 |
|
检测时间 |
注射后4周 |
案例5- 心脏
文章标题:
KLF9 Aggravates Streptozotocin-Induced Diabetic Cardiomyopathy by Inhibiting PPARγ/NRF2 Signalling
发表期刊:
Cells(IF 7.666)
合作客户:
徐州医科大学附属医院纵静/钱文浩研究团队
|
基因信息 |
转录因子KLF9 |
|
实验动物 |
18周龄雄性C57BL/6J小鼠 |
|
病毒产品 |
AAV9-cTnT-shKLF9 AAV9-shNC |
|
病毒用量 |
60 µL,6.5–7.5×10E13 GC/mL per mouse |
|
注射方式 |
眶后静脉丛注射 |
案例6- 心脏
文章标题:
NKRF in Cardiac Fibroblasts Protects against Cardiac Remodeling Post-Myocardial Infarction via Human Antigen R
发表期刊:
Advanced Science(IF 15.1)
合作客户:
山东大学齐鲁医院张澄/张猛/孔静团队
|
基因信息 |
人抗原R-HuR |
|
实验动物 |
8周龄雄性NKRF-CKO小鼠 |
|
病毒产品 |
AAV9-FSP1-shHuR |
|
病毒用量 |
2.8×10E11 vg /mouse |
|
注射方式 |
尾静脉注射 |
案例7- 胰腺
文章标题:
Autotaxin signaling facilitates b cell dedifferentiation and dysfunction induced by Sirtuin 3 deficiency
发表期刊:
Molecular Metabolism (IF 8.568)
合作客户:
香港中文大学 Alice P.S. Kong/田小雨教授研究团队
|
基因信息 |
Atx:外核苷酸焦磷酸酶/磷酸二酯酶(Enpp1-7)蛋白家族成员 |
|
实验动物 |
8周龄雄性Sirt3 f/f Sirt3 f/f;Cre/+ 小鼠 |
|
病毒产品 |
AAV8-insulin 1-shAtx AAV8-scramble |
|
病毒用量 |
1 x 10E12 genome copies |
|
注射体积 |
100 μL病毒混悬液 |
|
注射方式 |
腹腔注射 |
案例8- 肾脏
文章标题:
Auto- and paracrine rewiring of NIX-mediated mitophagy by insulin-like growth factor-binding protein 7 in septic AKI escalates inflammation-coupling tubular damage
发表期刊:
Life Sciences(IF6.780)
合作客户:
浙江省人民医院呼邦传老师课题组
|
基因信息 |
NIX:线粒体膜蛋白基因 |
|
病毒产品 |
AAV9-KSP1.3-miR30-sh.NIX AAV9-sh.scr |
|
实验动物 |
IGFBP-7 KO小鼠 |
|
注射方式 |
尾静脉注射 |
|
病毒用量 |
100 µL,1×10E12 copies |
