简介
钙通量测定是用于筛选G蛋白偶联受体(GPCR)的药物发现中的优选方法。 我们的Fluo-8®和Rhod-4™系列钙检测试剂是最亮的绿色和红色钙指示剂,而我们的Cal-520®和Cal-590™具有最高的细胞内钙检测信号/背景比,因为它们在 活细胞。 AAT Bioquest提供其他钙指标,如Fluo-4,Fluo-3,Fura-2,Indo-1,Rhod-5N和Rhod-2 AM,质量最高。
表1.钙检测试剂的光谱和Ca2 +结合特性
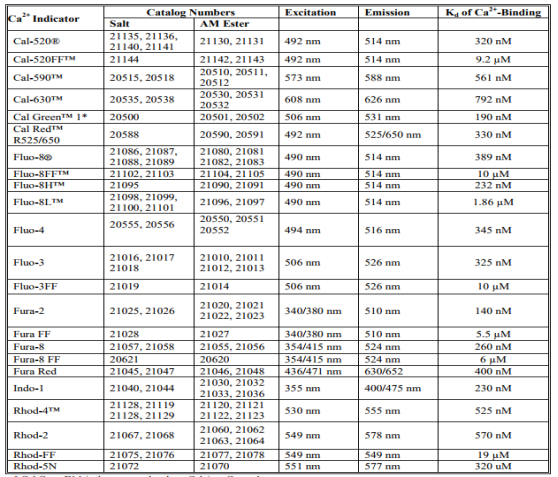
* Cal Green™1与Calcium Green-1的分子相同
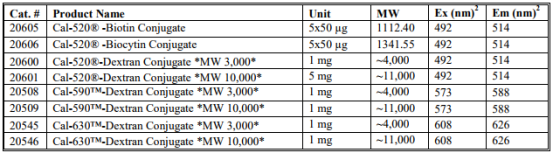
表2.葡聚糖,生物素或生物胞素缀合的荧光钙指示剂
储存条件
储存于-20°C,避光。 到期日为自收到之日起12个月。
使用钙指示剂AM酯类
1.使用钙指示剂AM Esters加载细胞:
AM酯是非极性酯,其易于穿过活细胞膜,并且通过活细胞内的细胞酯酶快速水解。 AM酯广泛用于非侵入性地将各种极性荧光探针装载到活细胞中。 但是,使用AM酯时必须小心谨慎,因为它们易于使用水解,特别是在溶液中。 它们应该用高质量的无水二甲基亚砜(DMSO)重新配制。 DMSO储备溶液应在-20°C下干燥保存并避光。 在这些条件下,AM酯应稳定数月。
以下是我们推荐的将AM酯加载到活细胞中的方案。 该协议仅提供指南,应根据您的特定需求进行修改。
a)在高质量无水DMSO中制备2至5mM AM酯原液。
b)在实验当天,将钙指示剂溶解在DMSO中固体或将等份的指示剂储备溶液解冻至室温。 使用0.04%Pluronic®F-127在您选择的缓冲液(如Hanks和Hepes缓冲液)中制备2至20μM的工作溶液。 对于大多数细胞系,我们建议钙指示剂的最终浓度为4-5μM。 指标的确切浓度细胞加载所需的必须根据经验确定。 为避免因过载和潜在染料毒性引起的任何伪影,建议使用能够产生足够信号强度的最小探针浓度。
注意:非离子型洗涤剂Pluronic®F-127有时用于增加钙指示剂AM酯的水溶性。 各种Pluronic®F-127解决方案可从AAT Bioquest购买。
c)如果您的细胞(如CHO细胞)含有有机阴离子转运蛋白,丙磺舒(2-5 mM)或磺吡酮(0.2-0.5 mM)可能会添加到染料工作溶液中(最终浓度为1) 对丙磺舒为-2.5 mM,对于磺胺吡喃酮为0.1-0.25 mM)以减少去酯化指示剂的泄漏。
注意:各种ReadiUse™丙磺舒(包括水溶性钠盐和稳定溶液)均可从AAT Bioquest购买
d)将等体积的染料工作溶液(来自步骤b或c)加入细胞板中。
e)将染料加载板室在温度或37℃下孵育20分钟(尤其是Fluo-8AM)至2小时,然后将板在室温下再孵育30分钟。
注1:降低加载温度可能会减少指示符的划分。
注2:孵育Cal-520 AM超过2小时可以为某些细胞系提供更好的信号强度
f)用HHBS或您选择的缓冲液(含有阴离子转运蛋白抑制剂,如1mM丙磺舒,如果适用)替换染料工作溶液,以去除多余的探针。
g)在所需的Ex / Em波长下进行实验(见表1)。
2.测量细胞内钙响应:
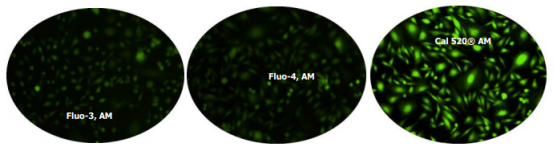
图1.没有丙磺舒的CHO-M1细胞中内源性P2Y受体对ATP的反应。将CHO-M1细胞在96孔黑壁/透明底板中以每100μL/孔40,000个细胞接种过夜。将100μl4μMFluo-3AM,Fluo-4AM或Cal 520 [表达] AM在HHBS中加入孔中,并将细胞在37℃下孵育2小时。用100μlHHBS替换染料加载培养基,加入50μl300μMATP,然后使用FITC通道用荧光显微镜(Olympus IX71)成像。
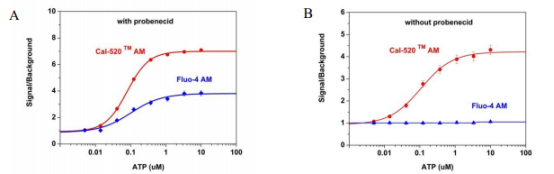
图2.用Cal520或Fluo-4AM测量的CHO-K1细胞中ATP刺激的内源性P2Y受体的钙响应。 在96孔黑壁/透明底板中,将CHO-K1细胞以每100μL/孔50,000个细胞接种过夜。 向细胞中加入100μL5μMFluo-4AM或具有(A)或不含(B)2.5mM丙磺舒的Cal-520 AM,并将细胞在37℃下温育2小时。 通过FlexStation(Molecular Devices)添加ATP(50μL/孔)以达到最终指示的浓度。
使用钙指示剂盐
为了确定溶液的游离钙浓度或单波长钙指示剂的Kd,使用以下等式:
[Ca]自由= Kd [F - Fmin] / Fmax - F]
其中F是指示剂在实验钙水平下的荧光,Fmin是不存在钙时的荧光,Fmax是钙饱和探针的荧光。 解离常数(Kd)是探针对钙的亲和力的量度。与校准溶液相比,荧光指示剂的Ca 2+结合和光谱性质在细胞环境中变化非常显着。细胞内指标的原位校准通常产生显着高于体外测定的Kd值。 通过在离子载体如A-23187,4-溴A-23187和离子霉素存在下将加载的细胞暴露于受控的Ca 2+缓冲液来进行原位校准。 或者,细胞透化剂如洋地黄皂苷或X-100可用于将指示剂暴露于细胞外培养基的受控Ca2 +水平。 表1列出了一些钙试剂的Kd值供您参考。
使用钙指示剂结合物
与游离离子指示剂相比,这些相同指示剂的葡聚糖缀合物表现出减少的区室化和低得多的染料渗漏率。由于葡聚糖的分子量,净电荷,标记程度和染料性质可能影响实验,建议研究人员咨询初级有关应用兴趣的信息的文献。
参考文献
1. J.T. Lock, I. Parker, I.F. Smith, A comparison of fluorescent Ca2+ indicators for imaging local Ca2+ signals in cultured cells, Cell Calcium (2015) October, http://dx.doi.org/10.1016/j.ceca.2015.10.003
2. Carsten Tischbirek, Antje Birkner, Hongbo Jia, Bert Sakmann, and Arthur Konnerth. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. PNAS. 2015; 112:11377-11382. doi: 10.1073/pnas.1514209112
3. Søren Grubb, Gary L. Aistrup, Jussi T. Koivumäki, Tobias Speerschneider, Lisa A. Gottlieb, Nancy A. M. Mutsaers, Søren-Peter Olesen, Kirstine Calloe, Morten B.Thomsen . Preservation of cardiac function by prolonged action potentials in mice deficient of KChIP2 American Journal of Physiology - Heart and Circulatory Physiology Published 1 August 2015 Vol. 309 no. 3, H481-H489 DOI: 10.1152/ajpheart.00166.2015
4. Emery Smith, Peter Chase, Colleen M. Niswender, Thomas J. Utley, Douglas J. Sheffler, Meredith J. Noetzel, Atin Lamsal, Michael R. Wood, P. Jeffrey Conn, Craig W. Lindsley, Franck Madoux, Mary Acosta, Louis Scampavia, Timothy Spicer, and Peter Hodder. Application of Parallel Multiparametric Cell-Based FLIPR Detection Assays for the Identification of Modulators of the Muscarinic Acetylcholine Receptor 4 (M4). J Biomol Screen. 2015; 20:858-868. doi:10.1177/1087057115581770.
5. Wenxiang Hu, Binlong Qiu, Wuqiang Guan, Qinying Wang, Min Wang, Wei Li, Longfei Gao, Lu Shen,Yin Huang, Gangcai Xie, Hanzhi Zhao, Ying Jin, Beisha Tang, Yongchun Yu, Jian Zhao, and Gang Pei Direct Conversion of Normal and Alzheimer’s Disease Human Fibroblasts into Neuronal Cells by Small Molecules. Cell Stem Cell 17, 204–212, August 6, 2015. http://dx.doi.org/10.1016/j.stem.2015.07.006
6. Carsten Tischbirek, Antje Birkner, Hongbo Jia, Bert Sakmann, and Arthur Konnerth. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. PNAS. 2015; 112:11377-11382. doi: 10.1073/pnas.1514209112
7. Songqing Tang, Taoyong Chen, Mingjin Yang, Lei Wang, Zhou Yu, Bin Xie,Cheng Qian, Sheng Xu, Nan Li, Xuetao Cao and Jianli Wang. Extracellular calcium elicits feedforward regulation of the Toll-like receptortriggered innate immune response. Cellular & Molecular Immunology , (17 August 2015) | doi:10.1038/cmi.2015.59.
8. Mayumi Tada, Atsuya Takeuchi, Miki Hashizume, Kazuo Kitamura, Masanobu Kano.Article. A highly sensitive fluorescent indicator dye for calcium imaging of neural activity in vitro and in vivo. European Journal of Neuroscience 9 JAN 2014. DOI: 10.1111/ejn.12476.
9.Daisuke Kodama, Akifumi Togari. Store-operated calcium entry induced by activation of Gq-coupled alpha1B adrenergic receptor in human osteoblast Biochemical and Biophysical Research Communications June (2013) doi: 10.1016/j.bbrc.2013.06.047.
