中枢神经系统是由许多不同类型的细胞构成的,包括神经元和神经胶质细胞。其中,根据不同的形态、大小和功能,神经元可以分为很多类型。而神经胶质细胞主要包括星形胶质细胞、少突胶质细胞和小胶质细胞。
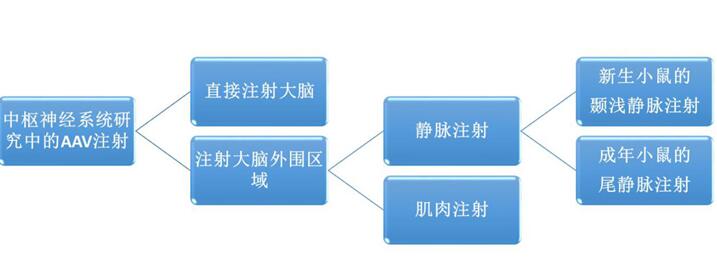
AAV在中枢神经系统(central nervous system,CNS)中的应用包括很多方面,比如在神经系统疾病和中枢神经系统损伤中的研究和治疗,以及某些神经系统疾病模型的局部转基因研究等。
由于AAV的血清型、转录因子和注射位点的不同,AAV在大脑中介导的转基因通常不是均一的,这种不均一表现在时间和空间(不同细胞种类的特异性)方面。除此之外,AAV病毒制备的技术(影响纯度和滴度)、病毒注射的方法也会大大影响到AAV介导的转基因的效率。值得注意的是,AAV感染后所使用的检测方法和目的蛋白的自然属性(胞内蛋白/分泌蛋白/转运蛋白)等因素也会影响到最终对转基因效果的评价。组织学染色,比如免疫组化或单/双免疫荧光可以帮助观察转基因表达的分布特征,但却不能量化评价病毒感染的效率。对脑提取物进行ELISA或RT-qPCR可以定量转基因效率。
事实上,通过将AAV直接注射大脑或大脑外围区域(肌肉或静脉注射)能够产生不同的转导模式。已经有文献证明AAV9可在小鼠/猫和非人灵长类动物中穿过血脑屏障。并且,AAV载体可以从肌肉逆行运输到脊髓运动神经元(27-30)。简单来说,就是运动神经元的轴突接触到AAV病毒,并将其传递给胞体。实验表明,AAV1的逆行效率较高。本文主要介绍几种在神经科学研究中常用的AAV注射方法。
一.通过立体定位仪直接向脑内注射AAV(需佩戴手套和口罩)
目前,成年雌雄大鼠和小鼠的大脑图谱都可通过文献和书籍获得。立体定位手术时,颅骨上常用的注射参照点就是前囱,也就是中矢状冠状缝的交叉点。具体的注射部位,可依据研究的需要而确定。微创技术可以避免炎症,以降低转导细胞的排斥反应。
1.安装定位仪: 在生物安全柜中安装立体定位框架和工具。
2.准备并吸满病毒悬液:在喷嘴出安装超微量注射器,把针尖浸在准备好的AAV病毒悬液中,并使用“快速反向”功能吸满。
3.排除空气:使用“快速正向”功能检查泡沫,知道在针头处出现一滴液体。用浸泡在0,1M NaOH溶液中的棉花轻轻拭去针尖的液滴。
4.麻醉大鼠:选取250g左右的大鼠,通过25 G 1毫升注射器注射甲苯噻嗪(10mg/kg)和***(100mg/kg)。
5.固定大鼠:首先将大鼠的下切牙固定在齿棒上,然后用耳棒通过大鼠的外耳道进行固定,并固定头部。检查颅骨是否是水平的,并确保两个眼睛在同一水平线上。在每只眼睛中滴入一滴聚丙烯酸,以防麻醉造成眼睛干燥。调整光源对准大鼠的头部,剃去头部的毛并用酒精消毒清洁。
6.切口并暴露前囱点:用刀片在头皮上前后轴切口,并用钳子保持刀口开放状态,用棉球吸去血。去除骨膜以便看到前囱。
7.暴露λ点:调整齿夹的垂直位置,使得前囱点和λ点的高度一致,如果λ点的位置难以看到,让切口处干燥5-10min后再寻找。
8.确定前囱点的AP和ML坐标和目标注射点的距离:将针垂直于前囱点,并记录AP和ML坐标的数值。参考大鼠脑图谱的标记的目标注射部位的AP和ML值,计算前囱点与目标注射部位的AP和ML坐标,并做标记。
9.确定前囱点的DV坐标和目标注射点的距离:用钻头在颅骨上打洞,注意不要损伤硬脑膜。把针尖置于硬脑膜的表面并测量出前囱点DV的坐标。计算目标注射部位的DV坐标。
10.注射AAV:缓慢垂直移动注射器针尖到达目标注射部位,慢慢地将针插入并静置5min。然后,以0.2 μ l/min的速度,将2μL的病毒悬液注射入脑。结束后,需要静置5min再将注射器缓慢移出。
11.缝合并做标记:缝合头皮,并做耳标。
12.大鼠术后的护理:将大鼠单独放在一个干净的笼子里,直到醒来。第一天需要让大鼠在独立的通风笼中度过。
13.处理针头和手术材料:先用0.1 M NaOH or 10%氯漂白剂清洗手术工具,并用蒸馏水冲洗,后用酒精冲洗。

图1:脑立体定位仪。(1)耳棒;(2)齿棒;(3)注射器支架;(4)设置垂直坐标的螺钉;(5)设置横向
坐标的螺钉;(6)设置前后坐标的螺钉;(7)垂直游标刻度;(8)侧游标刻度;(9)前后游标刻度。
二.静脉注射AAV9
(一)新生小鼠的颞静脉注射
1. 调整光源位置以便照亮显微镜区域,中等强度的光照佳。
2. 将一个新生幼鼠直接置于冰上1-3min,进行麻醉。
3. 当动物在冰上麻醉时,在注射器中注满AAV病毒。体积不应超过100μL,体积在30到100μL之间不会影响转导效率。
4. 在显微镜下观察幼鼠。用不持注射器的手的食指放在幼鼠口鼻处,中指放在耳芽处,以便拉伸幼鼠的皮肤,可见颞浅静脉。
5. 确定颞浅静脉。可通过皮肤看到位于耳芽前部,周围毛细血管下部,有一条隐约可见的静脉血管,从背部到腹部,汇入颈静脉,这就是颞浅静脉。
6. 注射器针尖斜面插入颞静脉。可以看到针尖斜面通过皮肤的以后被血填充。轻压注射器,并注意幼鼠脸侧面的静脉变白。
(二)成年小鼠的尾静脉注射
1. 确保动物进入约束装置。
2. 用酒精擦拭尾巴。
3. 把尾巴置于温水中。
4. 将注射器吸满AAV病毒悬液。
5. 将注射器插入尾静脉中。如果没有瞄准,可以靠近尾巴根部再试一次。
6. 注射病毒溶液。体积控制在100-250μL。
7. 将小鼠放回笼内。
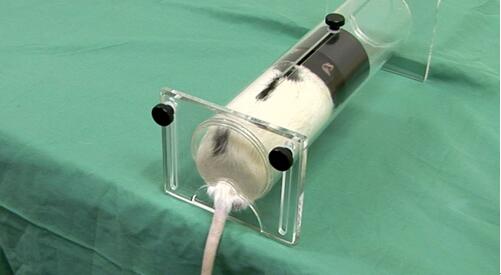
图2:动物约束装置
三.AAV从周围神经到目标神经元的逆行运输
1.选取250g左右的大鼠,通过25 G 1毫升注射器注射甲苯噻嗪(10mg/kg)和***(100mg/kg)。
2.将麻醉后的大鼠置于无菌布上。在每只眼睛中滴入一滴聚丙烯酸,以防麻醉造成眼睛干燥。
3.刮去肌肉附近的毛发并用酒精清洁。用刀片在皮肤上切一个小口,并用钳保持刀口开放,以暴露肌肉。
4.使用超微量注射器吸入AAV病毒悬液,并排除空气和气泡。
5.挤压肌肉以使肌肉建立起一定的厚度,并把针尖置于肌肉上。
6.缓缓插入针尖,并在肌肉中静置1min。然后以10μl/min的速度注入10-20μl的AAV悬液。
7.注射结束后,将针在肌肉中静置2min,然后缓缓拔出。可进行多次注射。
8.缝合皮肤并做耳标。将大鼠单独放在一个干净的笼子里,直到醒来
9.先用0.1 M NaOH or 10%氯漂白剂清洗手术工具,并用蒸馏水冲洗,后用酒精冲洗。

图3:超微量注射器
