肠隐窝-绒毛结构可以在不含有其它影响因素的情况下,单独对原代上皮组织进行调控机制的研究【1】。2009年,荷兰科学家Hans Clevers团队在体外成功地将小鼠Lgr5+肠道干细胞培养成小鼠小肠类器官(mSIOs),这种类器官模型重现了隐窝样区域和绒毛样上皮区域的三维结构。mSIOs的培养可以通过iPSCs或ESCs来诱导分化,也可以取小肠的隐窝干细胞来诱导分化。通过一系列的优化条件摸索,已经能够准确地模拟小鼠小肠上皮的生理情况,并且在体外长期培养,目前已经广泛应用于疾病模型、再生医学等相关研究。
而对于人源小肠类器官(hSIOs)培养的探索仍在进行中,虽然已经有了一些可以长期培养的hSIOs模型,但这些技术尚不成熟,除了原代细胞提取方法和维持细胞活性等技术困难外,如何准确地模拟细胞类型的多样性,并且促进hSIOs广泛地出芽,依然是hSIOs培养的瓶颈【2】。
基于以上因素,2022年Hans Clevers团队在hSIOs培养基中添加了IL-22进行hSIOs培养基的优化(图1)。利用优化后的hSIOs模型,探索了IL-22对hSIOs中各种类型上皮细胞的诱导效果和基因表达的影响。
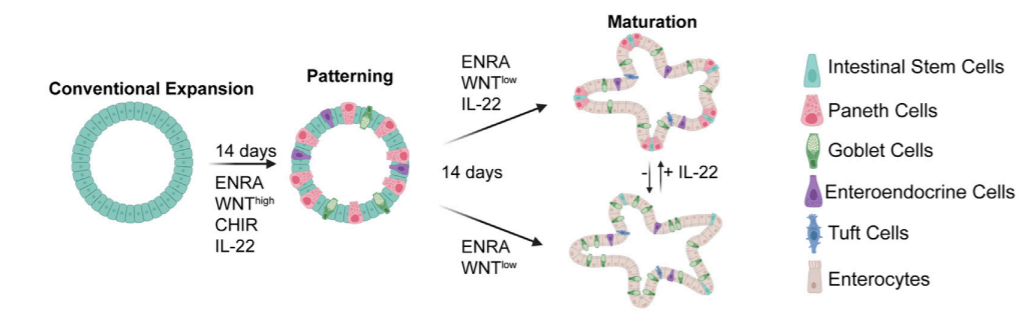
图1. hSIOs 的培养模型示意图【3】
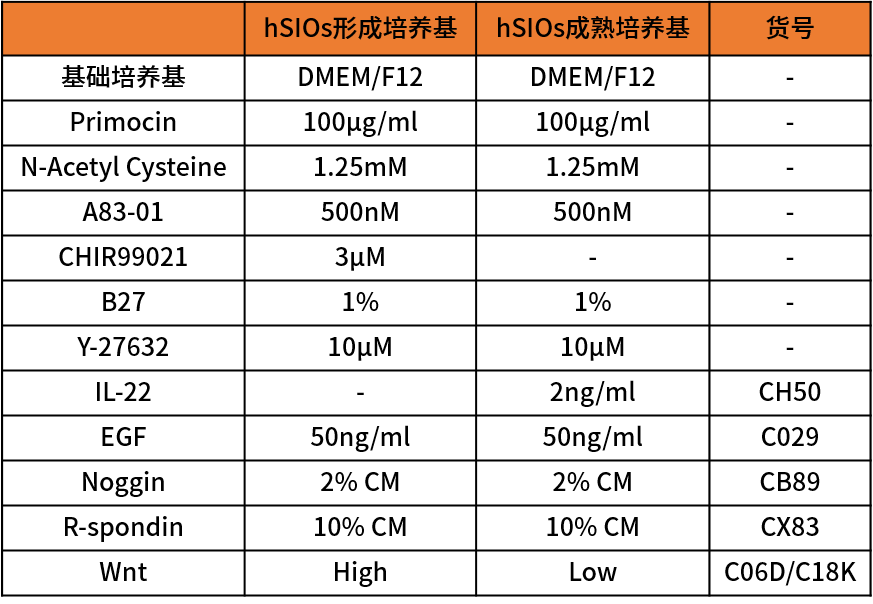
hSIOs培养基配方
成熟的hSIOs在整个类器官结构中分散表达潘氏细胞(Paneth cell), 肠内分泌细胞(enteroendocrine cell), 杯状细胞(goblet cell)(图2)。添加 IL-22后分化出的潘氏细胞主要位于芽底部,这与体内定位于肠隐窝的潘氏细胞相吻合。肠道中的潘氏细胞对于调节机体的防御功能至关重要【4】,在hSIOs中,潘氏细胞是肠道抗菌肽(如溶菌酶和防御素)的主要生产者,而IL-22是形成潘氏细胞所必需的细胞因子,敲除IL-22【5】或敲除IL-22Ra1【6】的小鼠会有明显的潘氏细胞缺失;随后的研究也表明了PI3K/AKT/mTOR信号通路对于IL-22诱导的人潘氏细胞形成至关重要。值得注意的是,mSIOs培养基中不需要额外添加IL-22来诱导形成潘氏细胞【7】,这也进一步证明了hSIOs与mSIOs的培养过程中需要选择不同的培养方式。
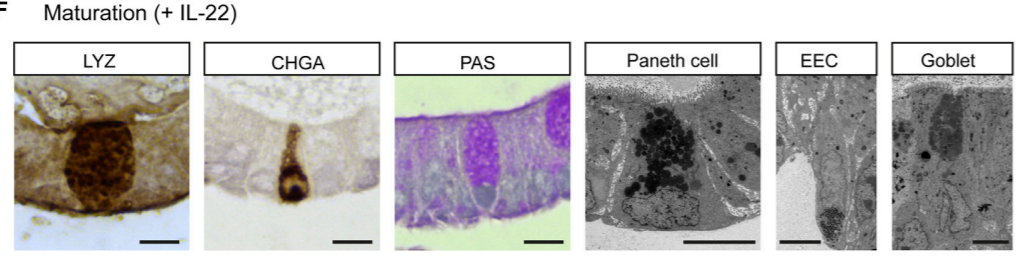
图2. 添加IL-22培养的成熟hSIOs中,存在多种类型细胞。潘氏细胞 (LYZ), 肠内分泌细胞 (CHGA), 杯状细胞 (PAS)【3】
IL-22能够诱导增加hSIOs中潘氏细胞的数量,以及促进AMP在所有细胞类型中的表达,在通过PI3K / AKT / mTOR轴诱导人类潘氏细胞分化程序中有着重要的作用。多种细胞构成的人类肠道类器官(HIO)技术为功能建模和修复人类肠道发育中的遗传缺陷【8】、以及建立慢性疾病模型(如炎症性肠病)【9】提供了研究的模型和可靠的平台。
近岸蛋白自主研发高质量不同种属的IL-22重组细胞因子,具有高活性、高纯度、高批间一致性,为类器官培养设计,已获得市场认可,让您研究放心!
推荐产品
|
货号 |
产品名称 |
|
Human EGF |
|
|
Mouse EGF (C-6His) |
|
|
Recombinant Human IL-22 |
|
|
Recombinant Mouse IL-22 |
|
|
Human Noggin |
|
|
Mouse Noggin(C-6His) |
|
|
Human R-Spondin 1 (C-6His) |
|
|
Human Wnt3a |
|
|
Human Wnt3a V2 |
相关产品
|
货号 |
产品名称 |
|
Human/Mouse/Rat Activin A |
|
|
Human/Mouse/Rat BDNF |
|
|
Human/Mouse/Rat BMP-2 |
|
|
Human DKK1 (N-8His) |
|
|
Human FGF basic/FGF-2 |
|
|
Mouse FGF basic/FGF-2 |
|
|
Human FGF-4 |
|
|
Mouse FGF-4 |
|
|
Human FGF-7/KGF |
|
|
Human FGF-9 |
|
|
Mouse FGF-9 (N-6His) |
|
|
Human FGF-10 |
|
|
Human FGF-19 |
|
|
Human GDNF |
|
|
Human HGF (C-6His) |
|
|
Mouse HGF (C-6His) |
|
|
Human LIF |
|
|
Mouse LIF |
|
|
Human NRG1-beta 1 |
|
|
Human NT-3 |
|
|
Human OSM (N-6His) |
|
|
Human Prolactin/PRL |
|
|
Human R-spondin 3 (C-6His) |
|
|
Human Shh |
|
|
Human Shh (C24II) |
|
|
Mouse Shh |
|
|
Mouse Shh(C25II) |
|
|
Human TGF-beta 1 |
欢迎各位扫码添加近岸小助手二维码,加入类器官培养交流群,在这里会有专业的技术支持人员帮您解惑答疑,也将定期分享类器官前沿进展,让类器官培养更简单!

近岸小助手
参考文献
【1】Sato T, Vries R G, Snippert H J, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche[J]. Nature, 2009, 459(7244): 262-265.
【2】Pleguezuelos‐Manzano C, Puschhof J, van den Brink S, et al. Establishment and culture of human intestinal organoids derived from adult stem cells[J]. Current protocols in immunology, 2020, 130(1): e106.
【3】He G W, Lin L, DeMartino J, et al. Optimized human intestinal organoid model reveals interleukin-22-dependency of paneth cell formation[J]. Cell Stem Cell, 2022.
【4】Bevins C L, Salzman N H. Paneth cells, antimicrobial peptides and maintenance of intestinal homeostasis[J]. Nature Reviews Microbiology, 2011, 9(5): 356-368.
【5】Chiang H Y, Lu H H, Sudhakar J N, et al. IL-22 initiates an IL-18-dependent epithelial response circuit to enforce intestinal host defence[J]. Nature communications, 2022, 13(1): 1-19.
【6】Gaudino S J, Beaupre M, Lin X, et al. IL-22 receptor signaling in Paneth cells is critical for their maturation, microbiota colonization, Th17-related immune responses, and anti-Salmonella immunity[J]. Mucosal immunology, 2021, 14(2): 389-401.
【7】Gaudino S J, Beaupre M, Lin X, et al. IL-22 receptor signaling in Paneth cells is critical for their maturation, microbiota colonization, Th17-related immune responses, and anti-Salmonella immunity[J]. Mucosal immunology, 2021, 14(2): 389-401.
【8】DEKKERS, Johanna F., et al. Characterizing responses to CFTR-modulating drugs using rectal organoids derived from subjects with cystic fibrosis. Science translational medicine, 2016, 8(344): 344ra84-344ra84.
【9】WELLS, James M.; SPENCE, Jason R. How to make an intestine. Development, 2014, 141(4): 752-760.
苏州近岸蛋白质科技股份有限公司,是一家专注于重组蛋白应用解决方案的高新技术企业,主营业务为靶点及细胞因子类蛋白、重组抗体、酶及试剂的研发、生产和销售,并提供相关技术服务。公司定位为医疗健康与生命科学领域原料与技术解决方案的上游供应商,致力于为下游客户提供及时、稳定、优质的产品及服务,助力全球生物医药企业和研究机构的技术与产品创新升级。
访问www.novoprotein.com.cn或致电400-600-0940。
