 期刊:Kidney Int
期刊:Kidney Int
影响因子:14.8
主要技术:SnRNA-seq
导语
慢性同种异体移植功能障碍(CAD)是导致同种异体肾移植损失的主要原因,其组织学特征为间质纤维化和肾小管萎缩。通过snRNA-seq和转录组分析,确定了CAD肾同种异体移植中纤维化形成细胞的起源、功能异质性和调控。从肾移植活检中分离单个细胞核,并成功地分析了来自5名CAD肾移植受者的23,980个细胞核和来自3名正常同种异体移植功能患者的17,913个细胞核。揭示了两种不同的CAD纤维化状态;低和高细胞外基质(ECM)具有不同的肾细胞亚群,免疫细胞类型和转录谱。大量细胞分析证实蛋白水平ECM沉积增加。近端肾小管细胞转变为损伤的混合肾小管(MT1)表型,由活化的成纤维细胞和肌成纤维细胞标记物组成,产生临时的ECM,激活炎症细胞,并作为纤维化的主要驱动因素。高ECM状态的MT1细胞实现了复制性去分化和肾源性转录信号的修复。低ECM状态下的MT1显示细胞凋亡减少,循环小管细胞减少,以及严重的代谢功能障碍,限制了修复的潜力。活化的B、T和浆细胞在高ECM状态下增加,而巨噬细胞亚型在低ECM状态下增加。移植后数年检测到肾实质细胞和供体来源的巨噬细胞之间的细胞间通信,在损伤的增殖中起着关键作用。因此确定了新的分子靶点,旨在改善或防止肾移植受体的同种异体移植纤维生成。
技术服务
SnRNA-seq
研究结果
1. 纤维化和正常移植物活检中细胞类型的鉴定
使用Banff标准,活检样本被分类为IFTA或正常/非特异性。41,893个单核的UMAP整合产生了18个主要的细胞簇。在纤维化和正常之间的1755个差异表达基因中,1006个DEG在纤维化中上调,118个与人类核心基质数据库重叠。在纤维化同种异体移植活检中,除了免疫细胞的不同类型和转录谱外,还鉴定了ECM基因谱的定性和定量差异。纤维化活检分为两种状态,低ECM和高ECM。核心染色体基因在高ECM状态下比低ECM状态下更丰富。FN1、COL1A1和VCAN在高ECM中存在差异表达。为了验证蛋白水平上的基因表达,肾活检的成像细胞计数(IMC)证实了ECM沉积的存在和水平。COL1A1和VIM的表达从正常<低ECM<高ECM增加。GO分析显示,高ECM中炎症反应上调,与较高比例的免疫细胞相一致。纤维化中上调基因的通路和富集分析在细胞形态发生、伤口愈合和上皮细胞分化中具有重要意义。
2. 移植肾的细胞分布
近端肾小管(PT)细胞在正常肾移植物中大量存在。与正常移植物相比,高ECM组PTs显著降低,低ECM组PTs略有降低。与正常移植物相比,两种纤维化状态下成纤维细胞(FB)亚簇FB1升高。内皮细胞(EC)亚簇EC2在高ECM状态下更为丰富。与正相比,混合管状(MT)亚簇MT1在纤维化中的比例过高。免疫细胞从正常到低ECM到高ECM显著增加。低ECM和高ECM显示了不同的氧化石墨烯富集项和途径。KCNIP4在纤维化状态特异性的小管簇中上调。KCNIP4在促炎、促纤维化状态下上调,这种状态在急性肾损伤后持续存在。低和高ECM状态表现出不同的细胞分布和转录谱,支持纤维化状态的异质性。
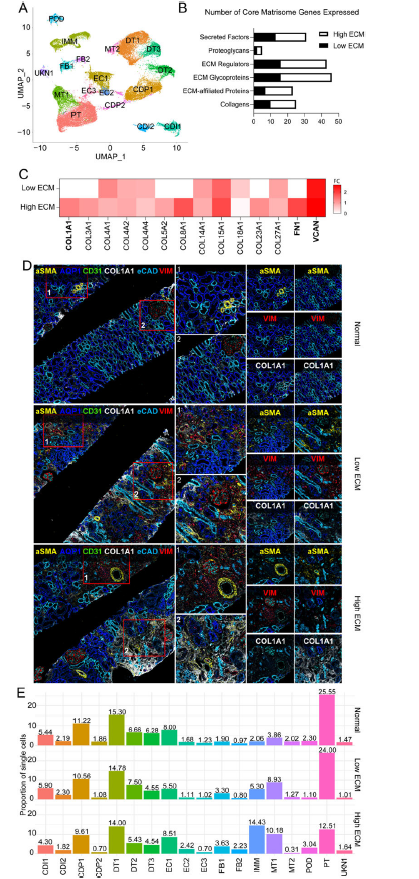
Fig 1. 正常/非特异性和纤维化人肾移植物的snRNA-seq分析
2. 小管上皮细胞损伤和移植物纤维化
两种纤维化状态下PT生理通路均下调。脂质和脂肪酸代谢改变在低ECM中更为显著。细胞周期阻滞与肾损伤有关,在肾小管细胞保护和不适应修复中起着重要作用。所鉴定的小管细胞簇(PT, MT1, MT2)在三组之间存在与细胞循环比例相关的差异,与正常相比,低ECM时略有下降,高ECM时略有增加。与高ECM和正常ECM相比,低ECM显示G2M细胞周期调节因子的表达减少。同种异体纤维化移植物的DEG分析显示,MT1过表达的基因富集于肌动蛋白丝基础过程、细胞形态发生、受体酪氨酸激酶和VEGF信号传导。高ECM的特征是细胞形态发生、白细胞分化和WNT信号传导。
在纤维化同种异体移植物中,MT1下调氨基酸降解,高ECM中T细胞的活化和分化富集。MT1是上皮细胞向间质转化(EMT)的中间转录状态。对于正常移植物,细胞轨迹终止于FB1,而纤维化移植物的轨迹延伸至FB2簇。这些离散的伪时间轨迹表明,基因表达的变化说明了两种不同的FB谱系起源于并结束于PT,导致从PT到FB2集群的功能转变。转录组学分析显示,MT1共表达PT和损伤25个marker。高ECM状态下的MT1表达更高水平的损伤marker。移植物损伤和正常PT标记物的正常表达可能是持续的亚临床免疫反应和慢性暴露于钙调磷酸酶抑制剂的结果。在高ECM的MT1中,增殖标记物(MKI67)和凋亡标记物(CASP3)的共同上调,受损PT细胞亚群经历了损伤诱导的复制。与低ECM和正常相比,高ECM MT1的SLC34A1表达减少,表明损伤的PT细胞去分化。在早期肾脏发育期间正常表达的肾源性特征与高ECM相关,而在低ECM中没有观察到。MT2细胞不像MT1细胞那么丰富,主要存在于正常的同种异体移植物中。

Fig 2. 混合管状细胞群细胞周期及基因表达分析
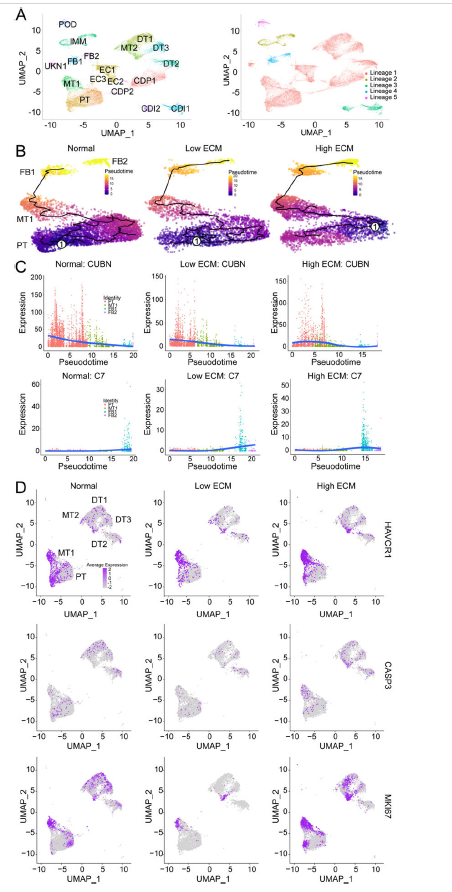
Fig 3. 近端小管细胞和混合小管细胞簇基因表达动态变化的拟时间和轨迹分析
3. 肾移植物中的成纤维细胞亚型
鉴定出两种不同的成纤维细胞簇(FB1, FB2)。FB1在纤维化肾脏中更丰富,富含肌成纤维细胞标记物。低ECM中FB1的GO分析显示细胞连接、局灶黏附和VEGF信号通路上调,而高ECM中ECM组织、平滑肌收缩和伤口愈合上调。FB2在高ECM中占主导地位,由PDGFR-β表达定义,并在周细胞标记物中富集。FB2相关信号通路包括RhoA、NOTCH和整合素激酶信号。在高ECM中,FB2通路与肌动蛋白丝为基础的过程、局灶黏附以及细胞运动和黏附的正向调节有关。FB1-2在高ECM中比低ECM中转录活性更强。谱系图谱分析确定了FB在正常和纤维化状态下的重编程轨迹。正常移植物中的FBs沿伪时间轨迹是均匀的,而纤维化移植物中的FBs则是不均匀的。这一数据支持FB在纤维化移植物中的功能表型转变。
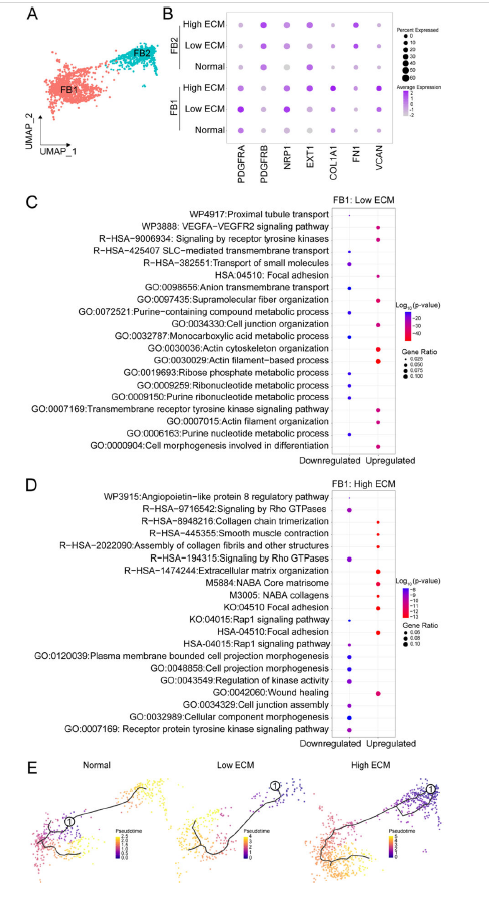
Fig 4. 成纤维细胞簇的基因表达及轨迹分析
4. 衰竭肾脏的免疫系统
总共分析了2,655个免疫细胞,并在研究组中确定了12个免疫亚群。正常同种异体移植物的免疫细胞最少。低ECM的骨髓细胞比例最高,包括各种巨噬细胞(MΦ1, MΦ2),经典和浆细胞样树突状细胞(cDC, pDC)和肥大细胞。高ECM的B细胞、血浆细胞、T细胞和Treg细胞比例最高。免疫细胞(T (CD4+, CD8+), B (CD20+)和MΦ (CD68+))的相对比例和空间分布通过福尔马林固定石蜡包埋活检的IMC染色进行评估。
高ECM的T细胞簇富集了与B和T细胞活化、NF-kB信号、TCR信号和Th17细胞分化相关的DEGs,这与MT1簇富集的活性增加相匹配。B细胞通路相关基因包括B细胞活化、白细胞趋化、内吞作用以及NF-kB和FC受体介导的刺激信号通路的调控。高ECM的浆细胞具有活跃的转录谱。
鉴定出三个巨噬细胞簇(MΦ1-3),并以常见的巨噬细胞标志物(CSF1R, MANBA, PLXDC2, RTN1, GRK3)为特征。MΦ1s通过抗原加工和递呈上调、HLA II类基因上调和Th1/Th2/Th17细胞分化进行分类。MΦ2s(以STAB1, F13A1, CD163, NRP1为特征)显示MHC ii类介导的抗原呈递和巨噬细胞M2相关的吞噬。MΦ1-2在高ECM肾移植物中也过表达CD74。
低ECM拥有最大的MΦ1和MΦ2群。在两种纤维化状态下,MΦ2的表达谱与细胞粘附和内吞作用调节有关,而IFN-α和-γ反应是高ECM所特有的。
使用三组性别不匹配病例的XY染色体相关基因表达特征来评估供体与受体免疫细胞对同种异体移植物的贡献。免疫细胞主要来自受体,小部分来自供体。没有证据表明受体存在非免疫细胞。对于一些样本,根据性别特异性基因的表达将免疫细胞群分为供体/受体特异性免疫细。移植后60个月,供体免疫细胞在肾移植中被鉴定出来。对样本KUT040中特定细胞类型的供体和受体标记的免疫细胞之间的DEGs进行了评估。这项原理验证分析显示,基于供体/受体来源的免疫细胞的差异贡献,支持常驻巨噬细胞在肾移植中介导和加剧免疫介导的炎症中的重要作用。
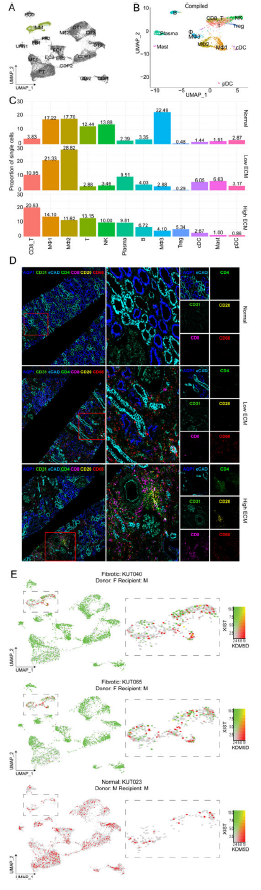
Fig 5. 人肾移植中的免疫细胞
5. 纤维化过程中的旁分泌信号
配体受体(LR)分析集中在细胞比例有显著差异的簇上,并在肾纤维化中具有重要意义。它们的成纤维细胞受体具有共同的功能作用,包括成纤维细胞激活和ECM扩展。
PDGFC是一种强效的促纤维化丝裂原,在纤维化移植物中分泌,支持成纤维细胞向肌成纤维细胞的转分化。NOTCH信号通路的上调也是共有的。TLRs通过DLL1触发巨噬细胞中的NOTCH信号,DLL1是高ECM分泌的主要NOTCH配体。对于低ECM, FB1-MΦ3 LRs也参与PI3K-Akt-mTOR信号传导。对于低ECM, MT1-MΦ3和MT1-MΦ1 LRs参与趋化性和管状/组织形态发生。细胞极性调节剂CELSR1-PSAP和成纤维细胞增殖和激活调节剂FGFR2-MAPK1等相互作用进一步支持低ECM中的EMT。在高ECM中,MT1-MΦ1(和FB1-MΦ1)相互作用反映了细胞因子介导的和NIK/NF-kB信号通路,与增加的免疫细胞丰度和激活一致。H&E和IHC染色进一步证实了LR与浸润细胞和受损肾脏结构的相互作用。低ECM肾实质显示纤维化斑块,而高ECM显示更紧密的纤维化区域。间质间存在和相对丰富的肌成纤维细胞在纤维化发病过程中起着关键作用。
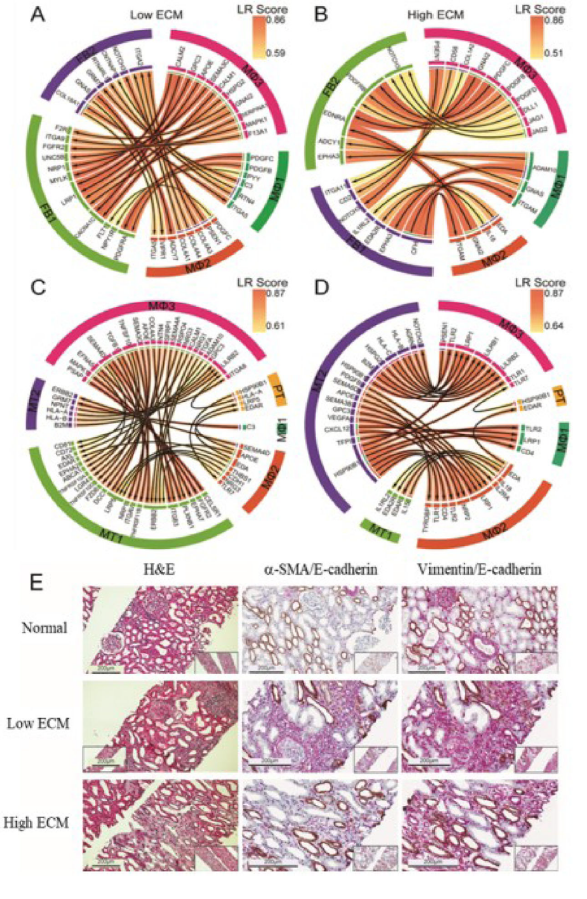
Fig 6. 细胞-细胞相互作用和染色组织空间验证
参考文献:
McDaniels JM, Shetty AC, Kuscu C, Kuscu C, Bardhi E, Rousselle T, Drachenberg C, Talwar M, Eason JD, Muthukumar T, Maluf DG, Mas VR. Single nuclei transcriptomics delineates complex immune and kidney cell interactions contributing to kidney allograft fibrosis. Kidney Int. 2023 Jun;103(6):1077-1092. doi: 10.1016/j.kint.2023.02.018. Epub 2023 Feb 28. PMID: 36863444; PMCID: PMC10200746.
