
编者按
类器官是成体干细胞或多能干细胞体外三维培养形成具有特定结构的组织类似物,与对应的器官具有高度相似的组织特性和生理功能。肿瘤类器官能够很好地保留癌症患者体内肿瘤的组织学和突变特征,在构建肿瘤类器官样本库、重建肿瘤微环境、研究肿瘤的发生发展机制以及制定个性化治疗方案和药物筛选等方面发挥了重要的作用,但目前仍存在着一些因素限制了肿瘤类器官的进一步发展。
今天,我们一起来分享由浙江大学医学院附属第四医院遗传医学研究所、环特生物院士专家工作站专家蒋明教授团队于2024年1月发表的综述性文章——《类器官在癌症基础研究和临床转化中的应用》,该文章综述了类器官技术在肿瘤基础研究和临床转化中的应用及面临的挑战,并对未来肿瘤类器官的发展方向予以展望。
文章题目:类器官在癌症基础研究和临床转化中的应用
杂志:《Tianjin Med J》
发表时间:2024年1月, Vol. 52 No. 1
作者:司吴雪蓉,蒋明
单位:浙江大学医学院第四附属医院遗传医学中心;浙江大学国际医学院遗传学研究所;浙江大学医学院和国家临床儿童医学中心消化科;浙江省遗传缺陷与发育障碍研究重点实验室
基金项目:科技部重大专项资助项目(2021YFC2501800);国家自然科学基金资助项目(32270863)
01、研究背景
癌症是疾病相关死亡的主要原因之一,全球发病率正在不断上升。在传统的癌症治疗方法中,患有特定类型癌症的大部分人都会接受类似“一刀切”的标准治疗,然而这些治疗方法对于不同患者表现有不同的治疗效果。癌症精准治疗是指根据癌症和个体的遗传特征,为每位患者匹配最准确、最有效的治疗方式。这就需要研究人员在体外构建出个性化肿瘤模型,该模型需要具备与原发肿瘤相似的遗传特征,能够反映患者的疾病进展和治疗靶点,以更准确地预测患者对药物的反应。
与传统的二维(2D)细胞系和患者源性异种移植(patient derived xenotransplantation,PDX)模型相比,肿瘤类器官与原始肿瘤的生物学特征更为相似,因此更有可能准确地预测患者对药物的反应。现就类器官技术在肿瘤基础研究和临床转化中的应用价值进行阐述。
02、类器官概述
类器官被定义为具有自我更新和自我组织能力的体外三维(3D)细胞簇,具有类似于体内器官的结构和功能,一般从组织驻留干细胞、祖细胞、胚胎干细胞或诱导多能干细胞发育而来,其培养过程会受到培养环境的物理特征、内外源信号、起始细胞类型以及系统条件的影响。目前类器官可用于模拟器官发育和疾病建模,在基础研究、药物发现和再生医学中具有广泛的应用。
1.1 肿瘤类器官的构建
肿瘤类器官是3D原代肿瘤细胞培养物,保留了原始肿瘤的组织学和突变特征。患者源性肿瘤类器官(patient-derived tumor organoids,PDOs)一般可以通过穿刺活检和手术切除肿瘤来构建,肿瘤细胞被包裹在细胞外基质(extracellular matrix,ECM)中,并需要在生长培养基中添加特定的生长因子进行培养。
PDOs 的培养方法因肿瘤类型不同而存在差异,目前大多数肿瘤类器官使用Matrigel水凝胶进行培养,该基质胶是由小鼠肉瘤细胞分泌产生的胶体蛋白混合物。培养基成分取决于类器官模型的种类,主要包括各种生长因子(R-spondin、Wnt 3A,成纤维细胞生长因子、表皮生长因子,Noggin等)、HEPES、GlutaMAX、烟酰胺、B27、小分子抑制剂,以及促进类器官生长的各种激素。
类器官构建成功与否需要通过HE染色、免疫荧光和基因测序等多个维度进行验证和评估;确定类器官与原始肿瘤的一致性是展开后续研究的先决条件。
1.2 肿瘤类器官的优势
在癌症研究中,传统的2D细胞培养和动物模型在基础研究中发挥了重要作用,但两种模型均存在一定的缺陷。2D细胞培养需要耗费大量的时间来建立肿瘤细胞的连续传代,因此不利于维持各种细胞亚型和亲本肿瘤的关键驱动基因表达。
细胞系作为体外选择的产物,在选择过程不可避免地会导致肿瘤分子特征的丢失,包括拷贝数变异、突变和内部异质性。并且细胞的单层培养无法模拟体内细胞与细胞间的相互作用,而这种相互作用对于信号通路和基因表达的调节至关重要,是细胞发挥生物学功能的基础。常用的动物模型包括转基因模型和PDX。
通过基因工程生成的动物模型无法真正模拟人类的致病过程,且该模型的生成也非常耗时。相比之下,通过将部分新切除的患者肿瘤直接移植到动物模型中构建而成的 PDX 模型可更好地保留肿瘤的重要特征。然而,PDX模型需要花费较长的时间来构建,才能使其具备较高的移植效率和表现出肿瘤细胞的宿主浸润特征。细胞系和PDX的衍生效率较低,不能为大规模的个体化治疗做出贡献。
此外,这两种模型通常来自晚期肿瘤,因此其不能完全捕获癌症发展全过程的生理特征。PDOs是在手术切除后最初几周内由肿瘤构建产生的,其最大的优势是可以有效地保留患者的遗传和表型异质性。与使用含血清培养基的2D培养细胞系相比,原发性肿瘤类器官细胞在多次传代中积累的遗传变异较少。3种模型在肿瘤建模和药物筛选中的特点见表1。
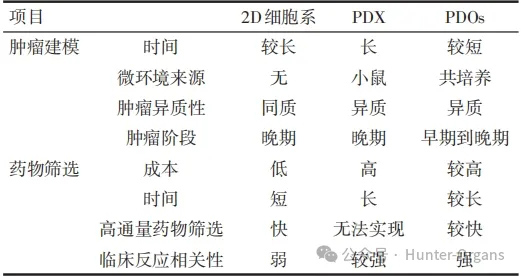
表1 2D细胞系、PDX和PDOs在肿瘤建模和药物筛选中的特点
03、类器官在肿瘤基础研究和临床转化中的应用
类器官不仅保留了与体内器官高度相似的组织学和遗传学特征,而且在预测抗癌药物方面具有极高的临床相关性,目前已被广泛应用于肿瘤基础研究和临床转化等方面,包括肿瘤类器官样本库、肿瘤微环境的构建,肿瘤发生发展机制的研究及个性化药物筛选,见图1。
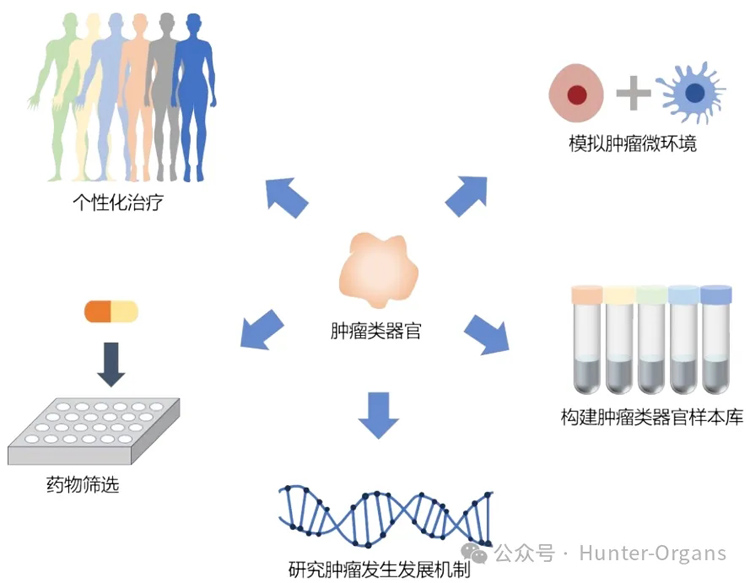
图1 类器官在癌症基础研究及临床转化中的应用
2.1 构建肿瘤类器官样本库
类器官生物库作为一种“活体库”,可以为基础和转化医学研究持续提供患者来源的样本,同时保留肿瘤组织的生物学特性。
与传统的生物样本库相比,类器官生物库应用范围更广泛,尤其是在肿瘤生物标志物筛选、药物靶点发现、耐药机制研究和药物疗效评价等方面。Petersen等发现ECM凝胶可用于培养正常人乳腺上皮细胞和人乳腺癌细胞后,随着3D培养技术的革新和培养基成分的优化,越来越多患者来源的肿瘤被用于构建类器官生物库。
目前,研究人员已成功培养了多种肿瘤类器官,包括结肠癌、胃癌、胰腺癌、前列腺癌、乳腺癌、肾癌、卵巢癌、子宫内膜癌等。肿瘤具有一定的异质性,包括肿瘤间异质性和肿瘤内异质性,这种异质性会随着病程的发展而加剧,从而导致患者对治疗的敏感性及预后情况不同。因此,全面了解肿瘤的异质性对于制定有效的治疗策略至关重要。
目前,已成功构建的乳腺癌、胃癌 、肾癌、肺癌,胶质母细胞瘤以及结直肠癌肝转移等类器官生物库均被证明很好地维持了患者内和患者间的肿瘤异质性,同时还保留了原始肿瘤的组织病理学和遗传学特征。部分肿瘤如胸腺瘤、间皮瘤、横纹肌肉瘤、胃肠胰腺神经内分泌肿瘤的发病较为罕见,缺乏可以有效进行药物筛选的临床前模型,阻碍了新型疗法的开发 。因此,这类肿瘤类器官库的成功构建将能够加速抗癌药物的研发。
综上所述,类器官生物样本库可以作为临床前细胞培养模型,为基础癌症研究、药物筛选和个性化医疗提供一系列具有代表性特征的模型。
2.2 重建肿瘤微环境
肿瘤微环境指的是肿瘤中存在的非癌细胞及它们产生释放的因子,其主要通过循环和淋巴系统与肿瘤细胞相互作用,进而影响癌症的发生和进展。癌症免疫疗法正迅速成为许多癌症的标准治疗方式,但患者的应答反应主要取决于癌症的类型和肿瘤靶分子的表达,这正是由于微环境的作用导致某些肿瘤细胞对免疫疗法产生了一定的抗性。许多研究都构建了癌细胞与非癌细胞的共培养模型,通过在体外模拟肿瘤微环境来探究细胞间的交互作用,这对于癌症治疗的研究具有重要意义。
通过气液界面交互技术植入天然免疫细胞后得到的PDOs 不仅准确保留了原始肿瘤的胞受体谱,还能模拟免疫检查点阻断过程。 T细除免疫细胞外,肿瘤相关成纤维细胞(cancer associated fibroblasts,CAFs)作为活化的成纤维细胞,能够产生和重塑细胞外基质,是肿瘤基质中最重要的细胞类型之一。
许多研究者将肿瘤类器官与相应患者来源的CAFs共培养,以探究CAFs在肿瘤发生与发展中的作用。Tsai等在人胰腺癌类器官和CAFs共培养模型中观察到了肌成纤维细胞样CAFs的活化与淋巴细胞的浸润。Luo等发现在未添加生长因子的情况下,CAFs能够维持水凝胶中结直肠癌PDOs的增殖。Schuth等同样发现CAFs促进了原代胰腺导管腺癌类器官的增殖,且类器官中上皮间充质转化相关基因的表达增加。
在有些肿瘤的发生过程中,内皮细胞也发挥着一定的作用。Lim等利用水凝胶系统建立了共培养模型以模拟和表征体外肝细胞和内皮细胞之间的血管分泌信号,从而探究内皮细胞在肝细胞癌发展过程中起到的作用。这些共培养系统有望促进肿瘤-微环境相互作用的研究,但这些模型仍在发展中,肿瘤微环境的构建是否对传统和新型研发药物具有耐药性,是否可以用于优化体外治疗反应,还需要更多的研究来证明。
2.3 研究肿瘤的发生及发展机制
基因组DNA序列的异常改变是正常细胞转化为癌细胞的重要原因。近年来,CRISPR-Cas9介导的基因编辑技术引起广泛关注,许多研究人员将其与类器官培养相结合,从而探究特定基因在癌症发生发展中的作用。
Lo等对人胃类器官进行了ARID1A的敲除,Dekkers等在乳腺祖细胞中敲除了4个乳腺癌相关的肿瘤抑制基因。Liu等从患者活检组织中生成了组成型Wnt激活的人巴雷特食管类器官模型,这些类器官在经过基因编辑后均表现出与肿瘤发生密切相关的现象,如更高的增殖复制能力、更少的细胞凋亡及黏液分化等。Takeda等同样通过对类器官进行基因编辑评估了单个基因(Apc和Kras)突变在结直肠癌中的致瘤能力,最终发现Acvr1b,Acvr2a和Arid2可以作为结直肠癌的肿瘤抑制基因,并揭示了Trp53在肿瘤转移中的作用。
此外,利用癌基因转化类器官模拟人体治疗过程,可以为耐药治疗提供更有效的信息,这样不仅可以建立肿瘤模型,还可以研究特定基因突变对药物的治疗反应。Verissimo等发现引入致癌 Kras 突变的正常结肠类器官对EGFR-RAS-ERK 通路靶向抑制剂的药物反应谱与RAS突变的结直肠癌类器官一致。这可能有助于证明相关突变基因对药物反应的影响,并排除如细胞状态、其他癌症突变的存在等复杂因素的干扰。
2.4 制定个性化治疗方案及药物筛选
个性化肿瘤模型的制定是开发个性化治疗方案的前提,研究人员发现类器官可以很好地保留患者体内肿瘤的特征,且微环境中残留的免疫细胞如肿瘤浸润性淋巴细胞,可以用来评估相应肿瘤类器官的杀伤效率。
利用微流体技术从患者肿瘤组织中快速生成的微器官球能保留大部分原始肿瘤驻留免疫细胞,且PD-1阻断和双特异性抗体等免疫疗法可以激活TILs以攻击MOS内的肿瘤细胞。Dijkstra等则证明自体肿瘤类器官和外周血淋巴细胞的共培养可以用来富集错配修复缺陷的结直肠癌和非小细胞肺癌患者外周血来源的TILs。实现构建个性化模型后的关键问题在于类器官能否准确预测出药物在患者体内的反应。大量研究表明抗肿瘤药物在类器官中的反应与患者体内反应一致,且经类器官筛选得到的药物在患者体内也具有一定的疗效,这些在乳腺癌、胰腺癌、结直肠癌和胃食管癌中均已得到证实。
利用类器官进行药物筛选具有筛选周期短、准确性高的特点,对指导患者用药和临床试验,以及加快抗癌药物的研发具有重要作用。目前已经建立了一些相对成熟的类器官高通量药物筛选平台,利用PDOs可以在1周内完成药物筛选,具有较高的转化应用价值。但类器官中肿瘤微环境的不完全保留会限制其筛选免疫检查点抑制剂和抗血管生成类药物,且在基于癌症类器官药物筛选更广泛地应用于个性化治疗之前,还需要进一步评估其对不同癌症类型的稳定性、可重复性和适用性。
04、研究困境与挑战
虽然多项研究证明,类器官在肿瘤基础研究和临床转化中具有广泛的应用,具备高度的临床相关性,能够有效地对患者进行药敏试验,使个体化的精准肿瘤治疗成为可能。但类器官技术仍处于发展的早期阶段,许多因素限制了该技术的应用。首先,肿瘤微环境的 ECM 组成成分比仅富含层黏连蛋白或透明质酸的 ECM凝胶复杂,目前所构建的PDOs中肿瘤细胞-ECM间的相互作用还过于简单,且存在于原代PDOs中的基质细胞在长期培养过程中会逐渐丢失。
尽管已经开发了许多共培养体系,但仍然无法非常准确地复制出患者体内的微环境。因此,用体外构建的PDOs进行药物筛选与体内疗效的一致性仍需进一步探究。除微环境成分的缺乏,类器官还缺乏血管结构,由于氧气和营养物质在细胞间的扩散距离有限,类器官体积的增加易导致中心细胞的死亡。其次,由于生长因子和基质胶的成本较高,类器官的培养成本远高于2D培养细胞系,且培养过程更耗时,培养技术难度大。
目前,虽然已显示出将类器官技术用于非上皮癌的可行性,但该技术主要用于生成起源于上皮的恶性肿瘤。再者,类器官培养过程中,生长因子条件培养基中需要有小鼠来源的基质胶、胎牛血清等动物来源产品,因此无法直接实现临床上的转化,且这些提取物的组成存在批次间的差异,可能会影响实验的重现性。
最后,类器官的培养纯度也十分关键,正常类器官的过度生长易造成肿瘤类器官的污染,有时仅添加与肿瘤类器官相关的生长因子能够在一定程度上抑制正常类器官的生长。
05、小结与展望
类器官在近十几年间迅速发展,已在发育生物学、癌症前临床研究等领域取得了许多突破,如发现基因序列与抗癌药物敏感性间的关系,体外模拟肿瘤及其微环境以实现药物筛选,新型药物的研发和免疫疗法的评估等。肿瘤类器官在具备一定优势的同时又有一些限制,但随着技术的发展和研究的深入,类器官将能够更好地模拟人类肿瘤的特征并预测药物反应,从而避免临床过度治疗及不良反应,有利于提升精准治疗的水平,在肿瘤的基础研究和临床转化方面做出更大的贡献。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型、人诱导多能干细胞及多种癌种的类器官培养平台,欢迎有需要的读者垂询!
参考文献
[1] ABOULKHEYR ES H,MONTAZERI L,AREF A R,et al.cancer medicine Personalized:an organoid approach[J].Trends Biotechnol,2018,36(4):358-371. doi:10.1016/j.tibtech.2017.12.005.
[2]SHIN S H,BODE A M,DONG Z.Precision medicine:foundation of future cancer therapeutics the[J].NPJ Precis Oncol,2017,1(1):12. doi:10.1038/s 41698-017-0016-z
[3].PRIOR N,INACIO P,HUCH M.Liver organoidsresearch to therapeutic applications:from basic[J].Gut,2019,68(12):22282237. doi:-10.1136/gutjnl-2019-319256.
[4]FANG Z,LI P,DU F,et al.The role of organoids in cancer research[J].Exp Hematol Oncol,2023,12(1):69. doi:10.1186/s40164-023-00433-y.
[5]SUAREZ-MARTINEZ E,SUAZO-SANCHEZ I,CELIS-ROMEROM,et al. 3D and organoid culture in research:physiology,hereditarygenetic diseases and cancer[J].Cell Biosci,2022,12(1):39. doi:10.1186/s13578-022-00775-w.
[6]REN X,CHEN W,YANG Q,et al. Patient-derived cancerorganoids for drug screening:basic technology and clinical application[J].J Gastroenterol Hepatol,2022,37(8):1446-1454doi .:10.1111/jgh.15930.
[7]XU R,ZHOU X,WANG S,et al. Tumor organoid models in precision medicine and investigating cancer-stromal interactions[J].Pharmacol Ther,2021,218:107668.doi:10.1016/j.pharmthera.2020.107668.
[8]KOPPER O,DE WITTE C J,LÕHMUSSAAR K,et al. An organoidplatform for ovarian cancer captures intra- and interpatient heterogeneity[J].Nat Med,2019,25(5):838-849. doi:10.1038/s 41591-019-0422-6.
[9]XIA T,DU W L,CHEN X Y,et al.microenvironment and their applications Organoid models of the tumor[J].J Cell Mol Med,2021,25(13):5829-5841.doi:10.1111/jcmm.16578.
[10]IDRISOVA K F,SIMON H U,GOMZIKOVA M O.Role of patient derived models of cancer in translational oncology[J].Cancers(Basel),2022,15(1):139. doi:10.3390/cancers15010139.
