肠上皮是成年哺乳动物中自我更新最快的组织,平均自我更新时间少于5天。肠干细胞位于肠隐窝(intestinal crypt)底部附近,每个隐窝中的干细胞大约有4-6个,它们产生快速增殖的转运扩增(TA)细胞,肠细胞、杯状细胞和肠内分泌细胞都从TA细胞发育而来。TA细胞快速分裂、转运扩增的子细胞占据了隐窝的其余部分,并流向绒毛的侧面,在那里它们分化、吸收营养,最终在绒毛尖端凋亡【1】。
在体外可以由hPSCs来模拟胚胎肠发育的过程,通过添加高浓度的FGF4和Wnt3A,促使hPSCs衍生的终内胚层(DE)向中肠和后肠内胚层分化,并促进肠管样形态发生,进而产生包含吸收性肠细胞以及主要分泌谱系(包括Paneth细胞、杯状细胞和肠内分泌细胞)的肠类器官。本篇文章基于Nature protocols【2】整理了hPSCs细胞来源的肠类器官培养方案。
细胞来源
hPSCs
培养基配方
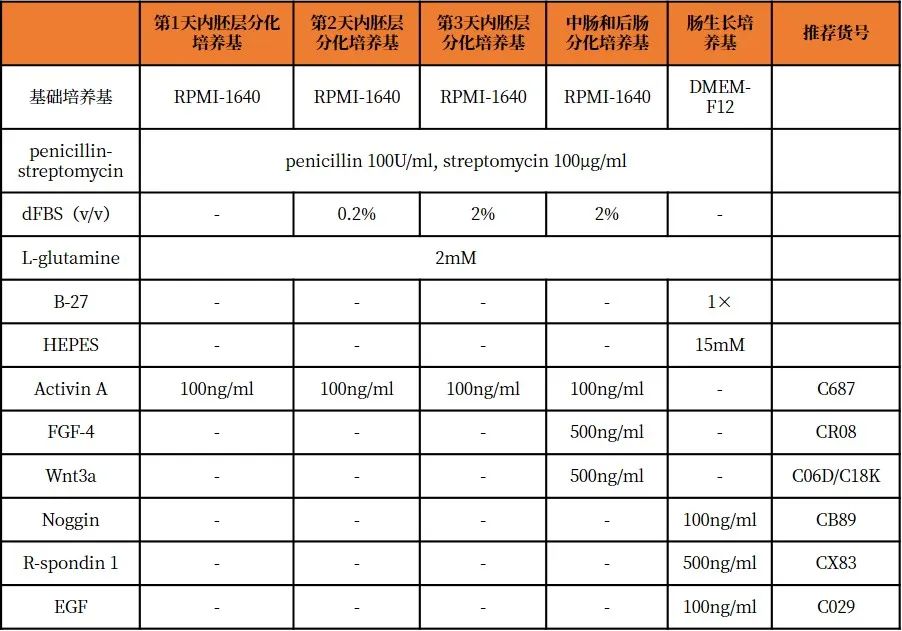
hPSCs培养和传代
1.将冻存的Matrigel在4°C下过夜解冻,在6孔板的每孔滴加1ml冷的Matrigel,旋动6孔板使Matrigel溶液分布均匀。随后转移至37℃条件下孵育10min使其凝固,使用前需室温静置1h。
2.将hPSCs接种在包被Matrigel的6孔板中,每孔加入3ml mTeSR1,放置在37℃,5%CO2的培养箱中,培养至细胞融合度约为75–85%、且大部分无分化的状态时,吸出培养基。
3.向hPSCs中加入1 ml Dispase(1mg/ml),并将培养皿放置在37℃条件下进行解离,直到所有的细胞都以小细胞块或单细胞的形式漂浮。向每个孔中加入5ml的DMEM-F12,以充分稀释Dispase。
4.将所有细胞转移至离心管中,室温下300g离心3min,收集沉淀细胞。加入DMEM-F12培养基,以1:6的比例接种在Matrigel包被的24孔培养板中,向每个孔中加入0.5ml预热的mTeSR1进行培养,在2-4天内细胞汇合度达到85-90%。
hPSCs分化成DE
5.吸出mTeSR1,向每个孔中加入0.5 ml预热的第1天内胚层分化培养基,并将平板放回37℃,5%CO2的培养箱中。
6.24h后,吸出第1天内胚层分化培养基,替换为每孔0.5ml预热的第2天内胚层分化培养基,并将平板放回37℃,5%CO2的培养箱中。
7.24h后,吸出第2天内胚层分化培养基,替换为每孔0.5ml预热的第3天内胚层分化培养基,并将平板放回37℃,5%CO2的培养箱中。
8.24h后,吸出第3天内胚层分化培养基,用不含Activin A的第3天内胚层分化培养基洗涤细胞一次。此时在显微镜下观察细胞,应该存在扁平的DE组织,该组织包含非常少的3D结构。
DE分化为中肠和后肠
9.从24孔板中吸出培养基,每孔滴加0.5 ml预热的中肠和后肠分化培养基。每24h更换一次新鲜中肠和后肠分化培养基,直至96h 。
10.在立体显微镜下,可以看到明显的3D结构。使用200μl移液器吸头从每个孔中收集球状体,并将大约50个球状体集中到1.5ml微量离心管中。
中肠和后肠球状体生长成人肠类器官
11.收集球状体后,将微量离心管垂直放置在管架上10min,此时球体通过重力沉降到离心管底部。吸出上清,控制总体积在25μl左右。
12.将冻存的Matrigel在4℃下过夜解冻,添加B-27补充剂(终浓度1×)、R-spondin1(终浓度500ng/ml),Noggin(终浓度100ng/ml)和EGF(终浓度100ng/ml),用移液器吹打混匀,配制成肠基质胶。
13.将球状体滴加在预冷的肠基质胶中,并将样品混匀,总体积将达到75μl(50μl基质胶+ 25μl培养基+球状体)。
14.将混合物接种在4孔板中,注意需接种在孔的中心,避免接触侧壁。
15.将4孔板放入37℃,5%CO2的培养箱中孵育10min,使Matrigel固化。
16.向每个孔中缓慢滴加0.5ml肠道生长培养基,确保基质胶被完全覆盖。
17.每隔4天,或当培养基中的酚红变黄时,更换肠生长培养基。
肠类器官传代
18.在第14天左右,通过将肠类器官重新包埋在新鲜的Matrigel中,来实现传代。
19.在显微镜下观察类器官,吸出孔内的培养基,加入少量DMEM-F12培养基。
20.使用200μl移液器吸头用力上下吹打Matrigel 3-5次,释放Matrigel中的类器官。
21.在37℃,5%CO2的培养箱中培养组织14天,每4天更换一次肠道生长培养基。
图1. 人肠类器官的培养过程【2】
肠类器官的新近应用进展
肠道类器官可以在体内移植,作为再生医学的临床前工具。2022年2月日本学者Satoshi Watanabe等人【3】利用右旋糖酐硫酸钠给药,在结肠远端引发上皮损伤,随后将肠道类器官原位移植到受体小鼠的结肠中,实现了上皮细胞的重建。这一步骤可在10分钟内完成,为肠类器官治疗溃疡性结肠炎的临床试验奠定了基础。
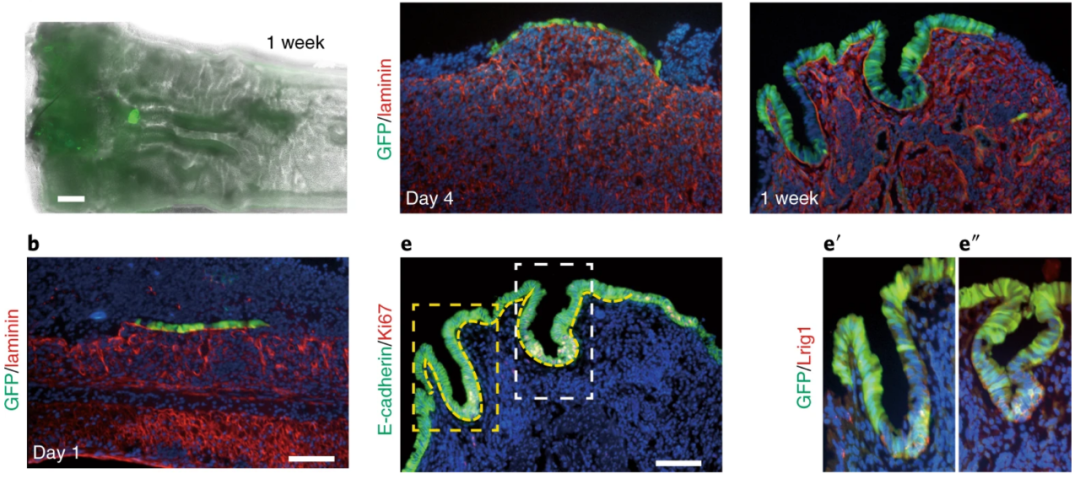
图2. 肠类器官(绿色)在移植1周后,成功整合到小鼠上皮损伤的区域【3】
类器官作为一种研究模型,在发育生物学、疾病病理学、细胞生物学、再生机制、精准医疗以及药物毒性和药效试验等方面潜力巨大。但是,类器官培养技术建立过程中会面临多种挑战。为了更轻松更高效的建立类器官培养技术,欢迎各位扫码加入类器官培养交流群,在这里会有专业的技术支持人员帮您解惑答疑,也将定期分享类器官前沿进展,让类器官培养更简单!

类器官培养交流群
推荐产品-肠类器官培养
|
货号 |
产品名称 |
相关产品:
|
货号 |
产品名称 |
参考文献
【1】SATO, Toshiro, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 2009, 459.7244: 262-265.
【2】MCCRACKEN, Kyle W., et al. Generating human intestinal tissue from pluripotent stem cells in vitro. Nature protocols, 2011, 6.12: 1920-1928.
【3】WATANABE, Satoshi, et al. Transplantation of intestinal organoids into a mouse model of colitis. Nature Protocols, 2022, 1-25.
苏州近岸蛋白质科技股份有限公司,是一家专注于重组蛋白应用解决方案的高新技术企业,主营业务为靶点及细胞因子类蛋白、重组抗体、酶及试剂的研发、生产和销售,并提供相关技术服务。公司定位为医疗健康与生命科学领域原料与技术解决方案的上游供应商,致力于为下游客户提供及时、稳定、优质的产品及服务,助力全球生物医药企业和研究机构的技术与产品创新升级。
详询www.novoprotein.com.cn或致电400-600-0940。
