Th17细胞由初始CD4+ T细胞分化而来,以前的研究认为CD4+ T细胞只能分化成Th1及Th2细胞。2005年,Th17细胞的概念首次被提出,因为能特异性的分泌高水平的IL-17而被命名为Th17细胞。它的发现源自对实验性自身免疫性脑脊髓炎及胶原诱导性关节炎的研究,Th17细胞参与了针对特定细胞外细菌和真菌的免疫反应。
小鼠体内Th17细胞分化分为3个阶段:在存在TGF-beta和IL-6的情况下,初始CD4+ T细胞分化为Th17细胞,这为诱导阶段。这些细胞因子通过激活STAT3,诱导IL-21的表达。IL-21的自分泌信号可以促进IL-23 R、IL-17A及转录因子ROR gamma t的STAT3依赖性表达,这为扩增阶段。IL-23 R与IL-12 R beta 1的聚合物形成功能性IL-23受体,在存在IL-23的时候,能稳定Th17表型,这为稳定阶段。目前认为ROR gamma t是Th17细胞的主要转录调节因子,因为它能够驱使IL-17A、IL-17F和IL-22的表达,这三个细胞因子是Th17细胞分泌的三个标志性细胞因子。其他参与Th17分化的转录因子,比如ROR alpha、Batf和IRF4,可能也参与调控IL-17基因的表达。
与小鼠Th17细胞的分化不同,人Th17细胞的分化需要IL-6、IL-21、IL-23和IL-1 beta,但似乎不太依赖 TGF-beta。另一个不同是,除了分泌IL-17A、IL-17F和IL-22之外,人类Th17细胞还分泌IL-26,IL-26属于IL-10家族细胞因子,没有小鼠同源物。
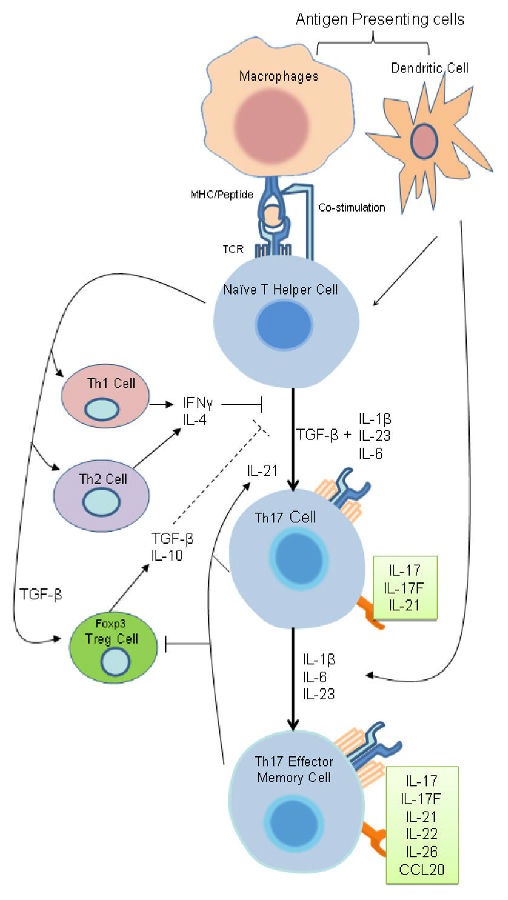
图1. Th17细胞分化图(图片来源于“Th 17 cells interplay with Foxp3+ Tregs in regulation of inflammation and autoimmunity”)
虽然Th17细胞分泌的细胞因子在消除有害微生物方面发挥重要作用,但这些细胞因子的持续分泌也可能会促进慢性炎症,并可能参与炎症和多种自身免疫性疾病,包括哮*、类风湿关节炎、多发性硬化症和炎症性肠病等。这里以哮*为例,Th17细胞通过产生大量的IL-17,招募中性粒细胞,促进多种细胞释放炎性因子,促使气道黏液腺分泌大量黏液,增加气道的高反应性,从而在哮*气道重塑的过程中发挥重要的作用。
Th17不仅跟炎症和免疫性疾病相关,还与肿瘤、神经元损伤和移植排斥等的发生和发展相关。这里以神经元损伤为例,Th17及其分泌的IL-17可以直接作用于神经元。通过血脑屏障的Th17细胞对神经元具有细胞毒性,与神经元共培养时可导致神经元细胞数量明显减少。
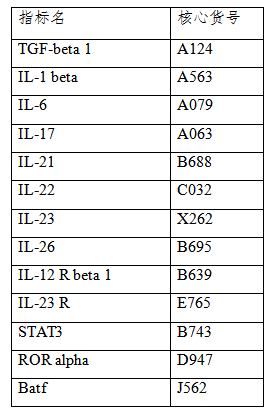
云克隆开发了Th17分化通路中涉及的细胞因子、转录因子等的相关产品,部分指标节选如下。
更多信息,欢迎访问http://www.cloud-clone.com/。
