肠道拥有人和动物体内最大的外周淋巴器官,与其中栖息的肠道微生物群形成密切的相互作用,进而影响全身的免疫系统。因此,了解肠道微生物群与免疫系统的共生关系不仅对免疫学领域至关重要,而且对理解各种系统性疾病(包括癌症、心血管代谢紊乱和肠道外自身免疫性疾病)的发病机制也至关重要。尽管微生物来源的抗原对于激活肠道免疫T细胞和B细胞至关重要,但微生物及其代谢物在指导这些免疫细胞的分化中也起着关键作用。
为此,Tadashi Takeuchi在Annual Review of Immunology发表题为“Microbial Metabolites and Gut Immunology”的综述,该综述强调了肠道微生物群产生的代谢物与免疫系统分化和功能之间的独特关系,揭示了微生物代谢物在调节适应性和先天性免疫细胞分化和功能中的关键作用。
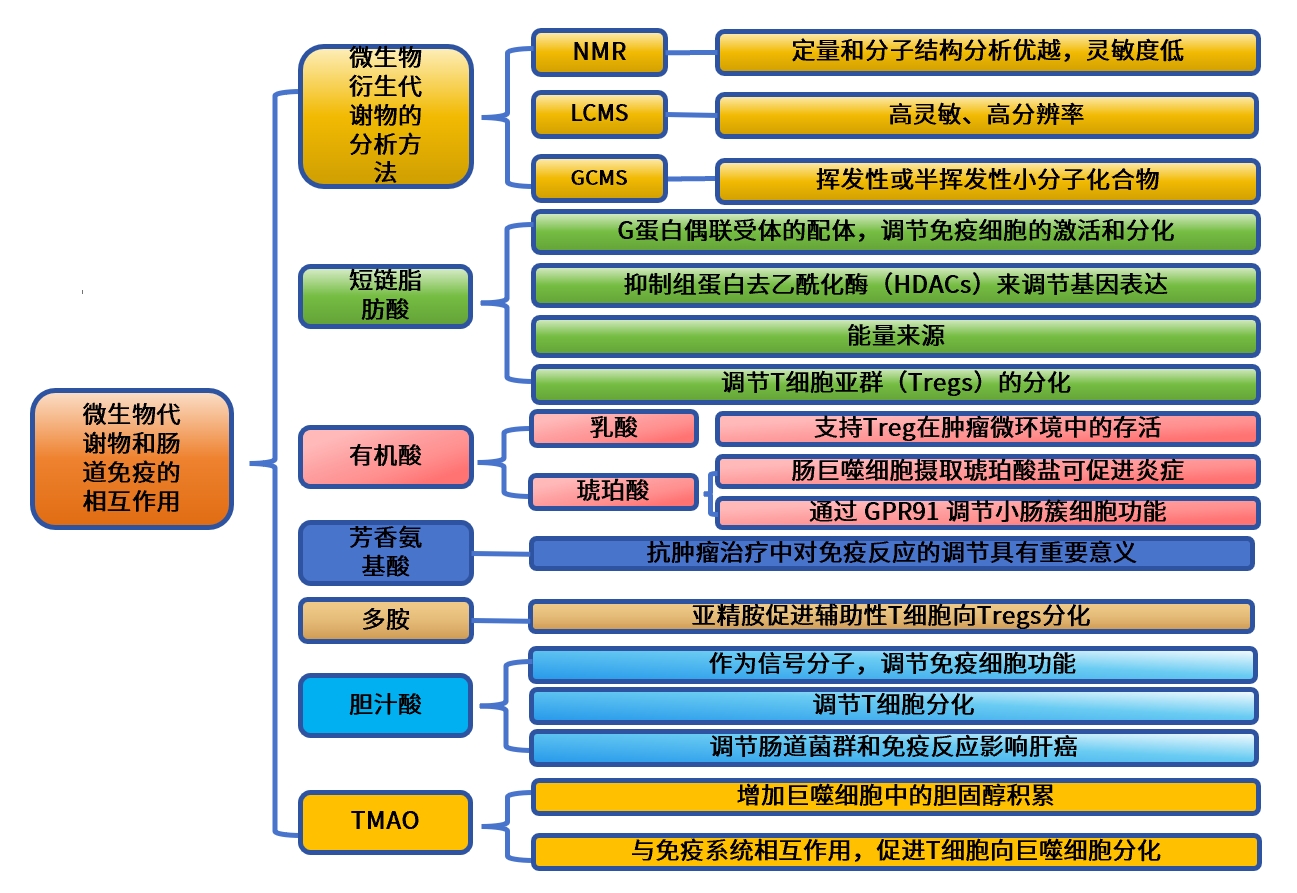
技术路线图
微生物衍生代谢物的分析方法
代谢组学是深入理解肠道微生物生态的重要技术,主要通过质谱(MS)或核磁共振(NMR)来获取数据。核磁共振在定量和分子结构分析上表现优越,尤其适用于原始生物样品,但其灵敏度相对较低。质谱与色谱技术(如气相色谱GC、液相色谱LC)结合,可有效改善复杂样品中代谢物的分离、定量和表征,但其高分辨率通常需要更长的分析时间。LC-MS由于其高灵敏度、易于样品制备、高分辨率和技术灵活性,成为代谢组学研究中最常用的平台。然而,在分析粪便代谢物时,需要注意饮食组成,特别是高脂肪饮食可能降低水溶性代谢物的提取效率,必须进行柱净化以去除脂质。
表1. 代谢组学技术在微生物组研究中的应用综述
短链脂肪酸
短链脂肪酸(SCFAs)是一类由肠道微生物产生的代谢物,对调节肠道内免疫细胞的功能至关重要。在人体内,SCFAs是碳水化合物(如膳食纤维)发酵的产物,是重要的膳食营养素。乙酸主要由拟杆菌、双歧杆菌等微生物产生;丙酸主要通过Lachnospiraceae和Negativicutes类细菌以及Bacteroides和Akkermansia等细菌产生;丁酸则是结肠上皮细胞的主要能量来源,由Faecalibacterium、Eubacterium、Roseburia和Ruminococcus等梭菌属细菌产生。
SCFAs通过多种机制影响宿主免疫:(1)作为G蛋白偶联受体(GPRs)的配体,如GPR43、GPR41和GPR109A,SCFAs能够调节免疫细胞的激活和分化,并在上皮细胞中传递信号。(2)SCFAs可以通过抑制组蛋白去乙酰化酶(HDACs)来调节基因表达,从而影响免疫细胞的功能。(3)作为能量来源,SCFAs可以转化为乙酰辅酶A,促进有氧呼吸并支持免疫细胞的激活。
SCFAs在肠道调节T细胞亚群(Tregs)的分化中也发挥着关键作用,尤其是丁酸,通过抑制组蛋白去乙酰化酶(HDAC)在肠道中诱导Foxp3+调节Tregs的分化。此外,丁酸作为树突状细胞(DCs)上的G蛋白偶联受体(GPR43)和GPR109A等SCFAs受体的配体,通过诱导IL-10促进Treg分化。
图1. 短链脂肪酸(SCFAs)的免疫作用
其他主要有机酸:乳酸和琥珀酸
乳酸作为厌氧代谢的终产物,由乳杆菌、乳球菌和双歧杆菌产生。乳酸及其代谢产物丙酮酸通过GPR31信号通路促进小肠中的CX3CR1+髓样细胞树突状突起,并增强口服耐受性。此外,乳酸发酵产物在小肠中诱导Treg细胞,并支持Treg在肿瘤微环境中的存活。
琥珀酸盐是肠道菌群丙酸合成途径中的中间体,在肠道免疫系统中,一方面,它通过GPR91调节小肠簇细胞功能引发Th2应答,另一方面,肠巨噬细胞摄取琥珀酸盐可促进炎症。此外,具核梭杆菌及其代谢物琥珀酸盐预示结直肠癌免疫治疗失败且效果依赖GPR91,进一步表明具核梭菌对结直肠癌的有害影响部分是其代谢产物。
芳香氨基酸及其衍生物
芳香氨基酸,如苯丙氨酸、色氨酸、酪氨酸和组氨酸,主要通过饮食获得,但肠道微生物也能合成它们。其中色氨酸代谢物通过与AhR受体结合,调节免疫细胞如T细胞、B细胞和先天细胞的功能。AhR在ILC3和Th17细胞上高表达,对产生IL-22至关重要,这种细胞因子在粘膜防御中发挥作用。研究还发现,乳酸杆菌通过色氨酸转化生成IAA,依赖于AhR信号促进ILC3产生IL-22。AhR的激活也影响Th17细胞的IL-22产生,并与结肠炎的保护作用相关。AHR在Treg细胞的分化和功能中也起着重要作用。研究发现色氨酸衍生的AhR配体通过特定机制引导Treg和Th17细胞的分化。
色氨酸代谢物在抗肿瘤治疗中对免疫反应的调节也具有重要意义。研究报道,3-IAA在对化疗有效的胰腺导管腺癌患者中升高,并在小鼠模型中显示其参与中性粒细胞的髓过氧化物酶活性,从而导致活性氧的积累。此外,罗伊氏乳杆菌产生的I3A在免疫检查点治疗期间增强了CD8 T细胞的抗肿瘤活性。
多胺
多胺,如精胺和腐胺,主要由微生物通过连续反应产生,并在调节肠道免疫系统中发挥重要作用。研究发现,微生物定植能通过NLRP6炎性小体诱导结肠上皮细胞产生IL-18和抗菌肽。精胺和腐胺在体外抑制IL-18的产生,而一种常见氨基酸—牛磺酸则增加其产生。此外,亚精胺促进辅助性T细胞向Tregs分化,提高小肠中的Tregs,并改善结肠炎。亚精胺对Treg极化的作用依赖于自噬途径,这表明自噬参与了该过程。尽管多胺在免疫代谢和癌症机制中具有重要作用,但微生物衍生的多胺的具体作用仍需进一步研究。
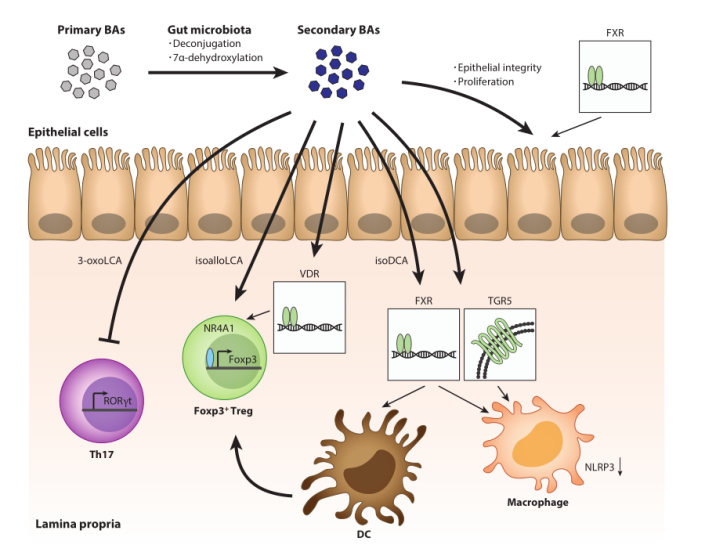
初级和次级胆汁酸
胆汁酸(BAs)传统上被视为乳化脂质的物质,有助于小肠吸收脂肪。但最新研究揭示它们还作为信号分子,调节免疫细胞功能。肠道菌群影响BAs的组成,通过代谢途径将初级BAs转化为次级BAs。这些BAs通过与特定受体相互作用,调节T细胞分化,如抑制Th17和促进Treg。同时,原代BAs可能对免疫细胞有害,需要MDR1等蛋白的保护。这些突显了胆汁酸在代谢与免疫相互作用中的双重角色。此外,BAs还通过调节肠道菌群和免疫反应影响肝癌的发生。
图2. 次生胆汁酸(BAs)的免疫作用
氧化三甲胺(TMAO)
TMAO是一种特性显著的微生物衍生代谢物,尤其在心脏代谢疾病中具有重要作用。研究表明,TMAO能增加巨噬细胞中的胆固醇积累,促进泡沫细胞(泡沫细胞是吞噬大量脂肪的巨噬细胞或平滑肌细胞,是导致动脉硬化的一种原因)形成,并可能通过激活NLRP3炎性小体来加剧血管炎症和内皮功能障碍。此外,TMAO还与免疫系统相互作用,促进T细胞向巨噬细胞分化,增强肿瘤微环境中的CD8 T细胞浸润。抑制细菌合成三甲胺TMA可有效减少TMAO的产生及其引发的动脉粥样硬化,提示TMAO可能成为治疗心血管疾病的新靶点。
小结
在这篇综述中,探讨了肠道微生物代谢产物如何复杂地参与肠道免疫系统。短链脂肪酸、氨基酸衍生物和次级胆汁酸通常来自肠道微生物群,而乳酸和琥珀酸则由人类和微生物共同合成。这些代谢物无论来源如何,都对肠道内的先天免疫细胞和适应性免疫细胞的分化与功能发挥着关键作用。由于作者对微生物代谢物的了解仍然有限,预计未来结合代谢组学和微生物工程的研究将揭示肠道中微生物-免疫相互作用的全面观点,从而为粘膜免疫学带来新的视角。
参考文献
Takeuchi T, Nakanishi Y, Ohno H. Microbial Metabolites and Gut Immunology. Annual Review of Immunology. 2024.
请扫描二维码阅读原文
绘谱帮你测
麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱拥有Q1000,Q500、Q300、Q200和胆汁酸、短链脂肪酸、色氨酸及咧咪衍生物、多胺和TMAO类等各类小分子代谢物、非靶向代谢组学和同位素示踪代谢流技术等共40+系列检测方法;已为数百家三甲医院、科研院所和企业提供多组学解决方案,协助客户与合作伙伴发表SCI文章400+篇,累计影响因子4000+,平均IF>10,包括Cell, Nature, Science, Cell Metabolism, Immunity, Gut, Hepatology, Microbiome等权威期刊。