简介
Fries重排反应是指在路易斯酸或布朗斯特酸( 如HF、AlCl3, BF3, TiCl4, 或 SnCl4)催化下,以酚酯作为原料重排合成邻位或对位酰基酚的反应[1]。Fries重排反应由德国化学家 Karl Theophil Fries 首先报道,以此以其名字命名,也是重要的人名反应之一。
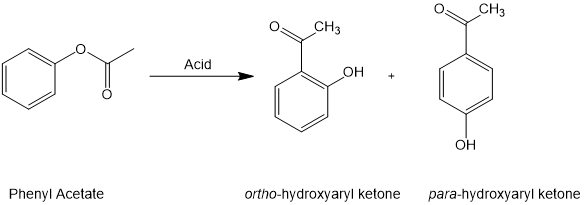
图 1.Fries重排反应
Fries重排也可以在没有催化剂的情况下进行,但是需要有紫外光的存在。产物仍然是邻位或者对位羟基芳酮。这种类型的Fries重排称为“光Fries重排”。光Fries重排产率很低,很少用于合成。不够苯环上连有间位定位基时仍然可以进行光Fries重排[1]。
硫杂-Fries重排是指在二氯甲烷体系中,氯化铝的催化下,芳基三氟甲磺酸酯重排生成为三氟甲磺酸亚砜基酚的过程[2]。
阴离子磷酸Fries重排会生成含有邻位碳-磷键的酚,可将芳基*** [ArOP(=O)(OR)2] 重排为邻羟基芳基膦酸酯[o-HO-Ar-P(=O)(OR)2][3]。
应用
Fries重排目前应用于以下领域:
n应用于以离子熔体[1-丁基-3-甲基咪唑鎓氯铝酸盐([BMIm]Cl·xAlCl3)]作为溶剂,以路易斯酸作为催化剂的合成条件下,苯甲酸苯酯重排反应生成邻位-羟基二苯甲酮和对位-羟基二苯甲酮[4]。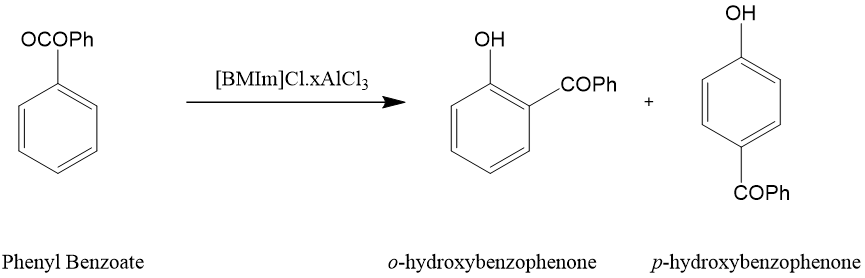
图2.对羟基二苯甲酮的合成
n医药中间体邻羟基苯乙酮和对羟基苯乙酮的合成。邻羟基苯乙酮和对羟基苯乙酮是重要的有机合成原料之一,是医药领域中用途广泛的中间体。而邻羟基苯乙酮和对羟基苯乙酮主要由乙酸苯酯的Fries重排反应合成[5]。
n维生素E(α-生育酚)的合成[6]。
n在TiCl4的催化下利用Fries重排并发生直接区域选择性酰化反应,合成邻位酰基羟基[2.2]对环戊烷[7]。
n农用化学中间体o-羟基苯丁酮和p-羟基苯丁酮的合成。o/p-羟基苯丁酮,为o-羟基苯丁酮和p-羟基苯丁酮的混合物,是一种新型农用杀菌剂。目前常以丁酸苯酯为原料,经过Friesc重排制备o/p-羟基苯丁酮[8]。
n在三氟甲磺酸钪的催化下,酰基萘经Fries重排,合成成羟基萘酮[9]。
n以3-甲基-2-丁烯酸芳基酯为原料,通过光-Fries重排和碱催化的分子内oxa-Michael加成反应,使用光化学一锅法合成5-、6-和7-取代的苯并二氢吡喃-4-酮[10]。
上述综合方案:
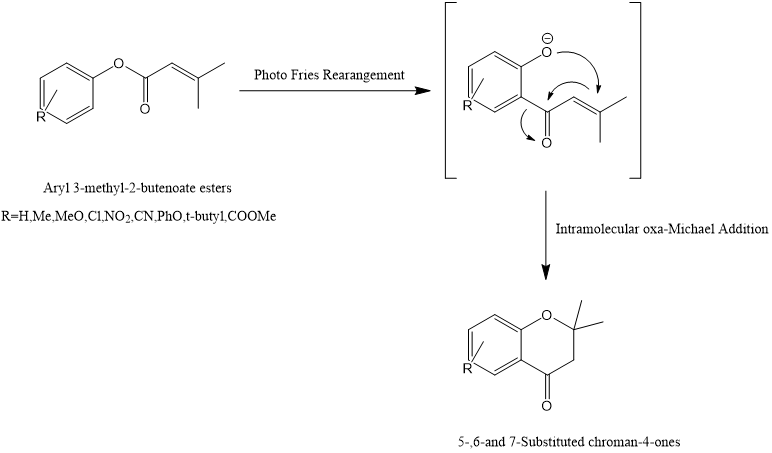
图3.Oxa Michael加成反应
研究进展
n关于硫代芳烃在无溶剂、微波介质加热条件下硫杂-Fries重排的相关研究[8]。
n反式和顺式solamin生物合成中的不饱和推定前体muricadienin的合成中,Fries重排是至关重要的步骤[10]。
n手性二茂铁基***通过阴离子磷酸-Fries重排合成含有非对映异构体的1,2-P,O-***,而后其将再进一步转化为对映体纯的磷烷[13]。
n关于负载在二氧化硅或其盐Cs2.5H0.5PW12O40 (CsPW)上的杂多酸H3PW12O40(PW)催化芳基酯的液相-Fries重排反应的研究[14]。
n阴离子磷酸-Fries已在二茂铁化学的相关研究中的成功应用[15]。
nFries重排以2,6-二甲氧基醌为原料,已用于合成抗病毒类黄酮先导化合物[16]。
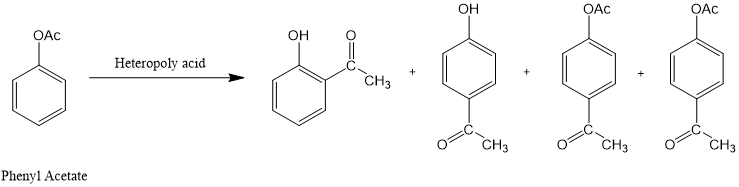
图4. 2,6-二甲氧基醌
n杂多酸H3PW12O40作为一种性能高效且环境友好的催化剂,已经应用于乙酸苯酯的Fries重排。
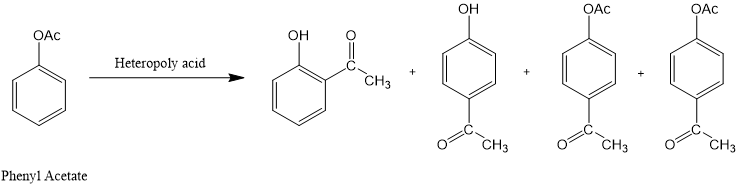
图5.乙酸苯酯
参考文献:
1.Bansal R K. 1996. Synthetic Approaches in Organic Chemistry. Jones & Bartlett Learning.
2.Chen X, Tordeux M, Desmurs J, Wakselman C. 2003. Thia-Fries rearrangement of aryl triflinates to trifluoromethanesulfinylphenols. Journal of Fluorine Chemistry. 123(1):51-56.
https://doi.org/10.1016/s0022-1139(03)00106-4
3.Taylor C, Watson A. 2004. The Anionic Phospho-Fries Rearrangement. COC. 8(7):623-636.
https://doi.org/10.2174/1385272043370717
4.Harjani JR, Nara SJ, Salunkhe MM. 2001. Fries rearrangement in ionic melts. Tetrahedron Letters. 42(10):1979-1981.
https://doi.org/10.1016/s0040-4039(01)00029-6
5.Jayat F, Picot MJS, Guisnet M. 1996. Solvent effects in liquid phase Fries rearrangement of phenyl acetate over a HBEA zeolite. Catal Lett. 41(3-4):181-187.
https://doi.org/10.1007/bf00811488
6.Termath AO, Velder J, Stemmler RT, Netscher T, Bonrath W, Schmalz H. 2014. Total Synthesis of (2RS)-?-Tocopherol through Ni-Catalyzed 1,4-Addition to a Chromenone Intermediate. Eur. J. Org.Chem.. 2014(16):3337-3340.
https://doi.org/10.1002/ejoc.201402240
7.Rozenberg V, Danilova T, Sergeeva E, Vorontsov E, Starikova Z, Lysenko K, Belokon .Y.Eur J. 2000. Org.Chem. 193295.
8.Moghaddam FM, Dakamin MG. 2000. Thia-Fries rearrangement of aryl sulfonates in dry media under microwave activation. Tetrahedron Letters. 41(18):3479-3481.
https://doi.org/10.1016/s0040-4039(00)00402-0
9.Kobayashi S, Moriwaki M, Hachiya I. 1995. The catalytic Fries rearrangement of acyloxy naphthalenes using scandium trifluoromethanesulfonate as a catalyst. J. Chem. Soc., Chem. Commun..(15):1527.
https://doi.org/10.1039/c39950001527
10.Iguchi D, Erra-Balsells R, Bonesi SM. 2014. Expeditious photochemical reaction toward the preparation of substituted chroman-4-ones. Tetrahedron Letters. 55(33):4653-4656.
https://doi.org/10.1016/j.tetlet.2014.06.081
11.Uraoka H, Kondo M, Kawatsuki N. 2014. Influence of End Groups in Photoinduced Reorientation of Liquid Crystalline Polymer Films Based on Axis-Selective Photo-Fries Rearrangement. Molecular Crystals and Liquid Crystals. 601(1):79-87.
https://doi.org/10.1080/15421406.2014.940508
12.Adrian J, Stark CBW. 2014. Total Synthesis of Muricadienin, the Putative Key Precursor in the Solamin Biosynthesis. Org.Lett.. 16(22):5886-5889.
https://doi.org/10.1021/ol502849y
13.Korb M, Lang H. 2014. Planar Chirality from the Chiral Pool: Diastereoselective Anionic Phospho-Fries Rearrangements at Ferrocene. Organometallics. 33(22):6643-6659.
https://doi.org/10.1021/om500953c
14.Kozhevnikova E. 2004. Fries rearrangement of aryl esters catalysed by heteropoly acid: catalyst regeneration and reuse. Applied Catalysis A: General. 260(1):25-34.
https://doi.org/10.1016/j.apcata.2003.10.008
15.Korb M, Schaarschmidt D, Lang H. 2014. Anionic Phospho-Fries Rearrangement at Ferrocene: One-Pot Approach to P,O-Substituted Ferrocenes. Organometallics. 33(8):2099-2108.
https://doi.org/10.1021/om5002827
16.Martin-Benlloch X, Elhabiri M, Lanfranchi DA, Davioud-Charvet E. 2014. A Practical and Economical High-Yielding, Six-Step Sequence Synthesis of a Flavone: Application to the Multigram-Scale Synthesis of Ladanein. Org.Process Res. Dev.. 18(5):613-617.
https://doi.org/10.1021/op4003642
17.Kozhevnikova EF, Derouane EG, Kozhevnikov IV. 2002. Heteropoly acid as a novel efficient catalyst for Fries rearrangement. Chem. Commun..(11):1178-1179.

