导读
 文章发表在Genomics, Proteomics & Bioinformatics
文章发表在Genomics, Proteomics & Bioinformatics研究团队对LSCC原发肿瘤组织(LC)、匹配的癌旁组织(PT)和局部淋巴结(LM)进行了单细胞转录组测序分析。该研究在上皮细胞亚群中标记了8类亚群,通过使用传统的干细胞标志基因PROM1和ALDH1A1,识别出一个稀有的干细胞(SC)群体(图1A)。研究发现,98.26%的SCs处于G1期,且SCs中与细胞周期相关的基因表达显著较低,即保持静息或缓慢增殖的状态。拟时序分析表明SCs处于上皮细胞的发育起点,这些特征符合对SCs的已有认知。
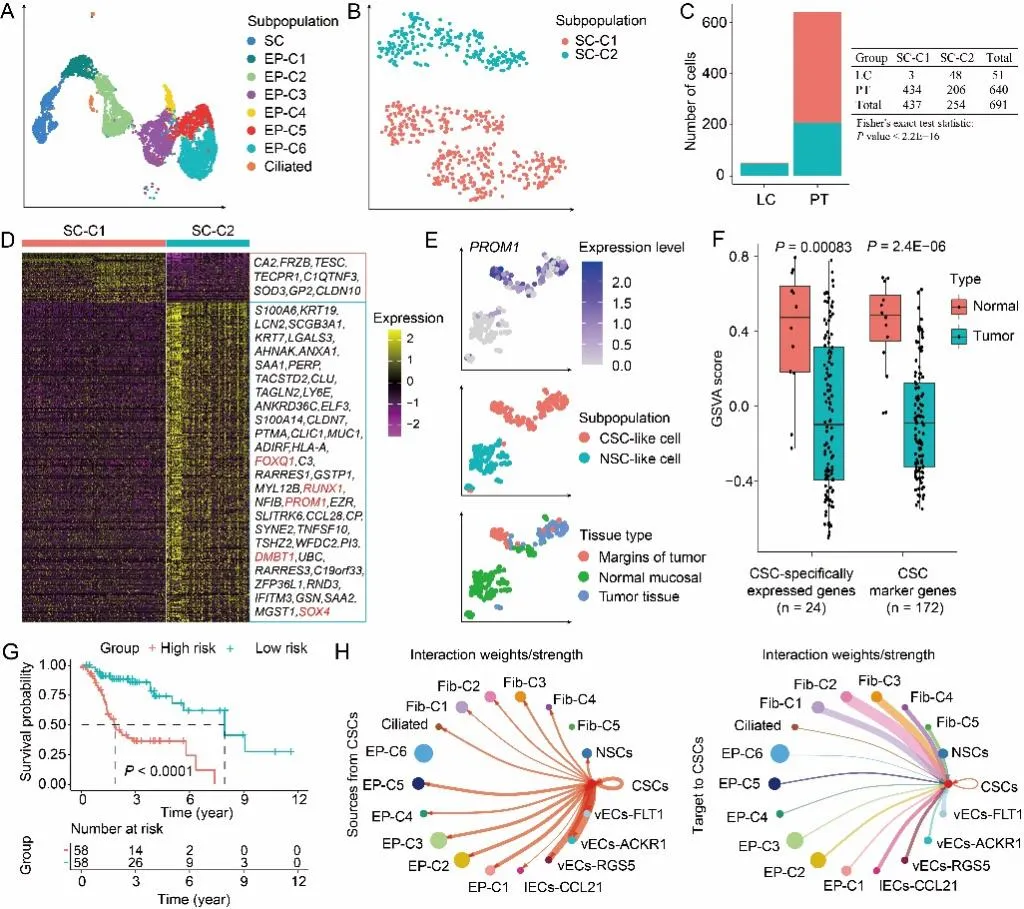
然而,肿瘤组织中可能同时存在肿瘤干细胞和正常干细胞(NSCs),进一步聚类分析获得SC-C1和SC-C2两个群体(图1B)。研究团队发现94.12%来源于肿瘤组织的SCs被归类为SC-C2,相反67.81%来源于癌旁组织的干细胞被归类为SC-C1(图1B)。与SC-C1相比,SC-C2表现出Wnt/β-catenin信号通路、Notch信号通路、低氧、MYC靶点、炎症和干扰素反应通路的高活性。转录因子活性分析显示,SC-C2中RUNX1(13g)和SOX4(20g)调控子的AUC评分显著高于SC-C1;与先前研究一致,RUNX1和SOX4通常与癌症复发、癌细胞干性的维持有关。SC-C2高表达FOLR1、CCL28、FRZB等标志基因,免疫组化也显示PROM1和FOLR1在癌旁组织中的表达水平高于肿瘤组织。综上,研究团队确认SC-C2具有明显的肿瘤干细胞特征,并且在癌旁组织中富集。进一步使用其他LSCC单细胞测序数据和TCGA数据也验证了CSCs的真实存在和组织定位(图E-F)。
鉴于肿瘤干细胞在癌症发展、复发和转移中的关键作用,其标志基因在临床中或具有重要应用潜力。研究团队筛选出了172个CSCs的标志基因,并利用多重免疫组化证实了其中3个(PROM1、FOLR1和DMBT1)在肿瘤组织切片中的表达。对肿瘤干细胞标志基因构建的预后模型,也获得了良好的预测准确性(图1G)。研究团队进一步鉴定了24个特异性表达的基因,并结合iLINCS数据库预测了若干潜在的靶向药物,即可能通过抑制特异性基因的表达来抑制CSCs的发生发展。
最后,研究团队还对肿瘤干细胞与免疫细胞、基质细胞之间的通讯网络进行了深入解析,发现髓系细胞表达的NAMPT诱导CSCs中INSR的高表达,推测抑制NAMPT是抑制CSCs的潜在靶点。相较于NSCs,该研究还发现CSCs具有调控血管细胞发展的能力,相关通路在CSCs中表现出更强和更特异性的模式(图1H)。
