噬菌体展示技术经过近20年的发展和完善,已被广泛应用于抗原抗体库的建立、药物设计、疫苗研究、病原检测、基因治疗、抗原表位研究及细胞信号转导研究等。噬菌体展示系统模拟了自然免疫系统,使我们有可能模拟体内抗体生成过程,构建高亲和力抗体库。由于噬菌体展示技术实现了基因型和表型的有效转换,使研究者在基因分子克隆基础上实现了蛋白质构象体外控制,从而为获取具有良好生物学活性的表达产物提供了强有力手段。另外,噬菌体展示技术已成为不经过免疫获取特异性人源抗体的新途径,为获取对人类和动物疾病有诊断和治疗价值的单克隆抗体提供了重要手段。
应用面这么高大上,那么原理到底是什么呢?那接下来将由小编为您揭开其神秘的面纱!
一、 噬菌体展示技术的原理
噬菌体展示技术(phage display)是将多肽或蛋白质的编码基因插入噬菌体外壳蛋白结构基因的适当位置,在阅读框正确且不影响其他外壳蛋白正常功能的情况下,使外源多肽或蛋白与外壳蛋白融合表达,融合蛋白随子代噬菌体的重新组装而展示在噬菌体表面。展示到噬菌体表面的多肽或蛋白保持相对独立的空间结构和生物活性,可以与靶分子结合和识别。噬菌体展示的肽库或蛋白库与固相抗原结合,洗去未结合的噬菌体,然后用酸碱或者竞争的分子洗脱下结合的噬菌体,中和后的噬菌体感染大肠杆菌扩增,经过3-5轮的富集,逐步提高可以特异性识别靶分子的噬菌体比例,最终获得识别靶分子的多肽或者蛋白。下图粗略展示了技术筛选的过程:
二、噬菌体展示系统的分类
1.M13噬菌体展示系统
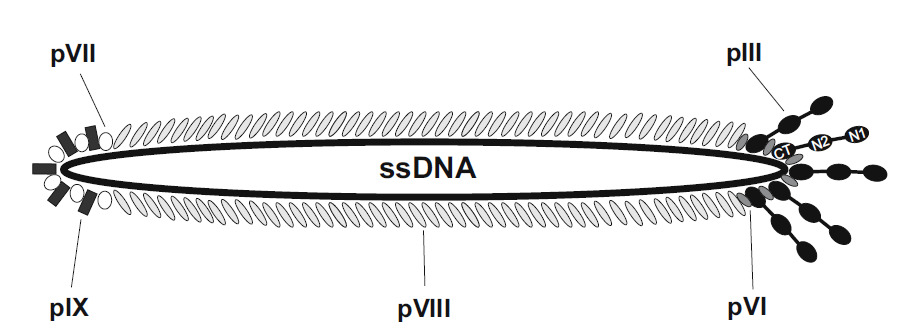
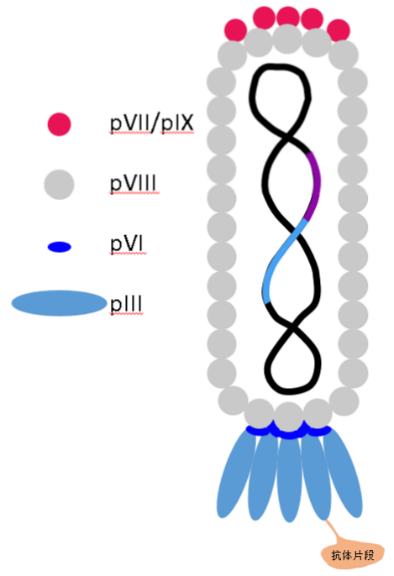
M13噬菌体属于单链环状DNA病毒,其基因组为6.4 kb,编码10种蛋白,其中5种为结构蛋白,包括主要衣壳蛋白的PⅧ 和次要衣壳的pⅢ 、pⅥ 、PⅦ 和PⅨ 。其中,pⅢ 和PⅧ 是噬菌体展示中最常用的两种蛋白,构建了pⅢ 和PⅧ 展示系统。pⅢ 蛋白分子量为42 kDa,分布在噬菌体颗粒的一端。一般一个噬菌体有3-5个拷贝的pⅢ 蛋白,可在N端的柔性连接区插入外源蛋白或者多肽。pⅢ 系统的主要优点是对展示的外源蛋白大小无严格的要求,该系统可以用来展示分子量较大的蛋白。PⅧ 蛋白的分子量为5.2 kDa,主要分布在噬菌体颗粒的两侧。由于该蛋白的分子量很小,只适合用来展示外源短肽。外源肽段的太大会影响病毒包装,不能形成有功能的噬菌体。但由于pⅢ蛋白拷贝数较多,该系统比较适合用来筛选低亲和力的配体。
2.λ噬菌体展示系统
λ噬菌体是长尾噬菌体科的一种温和噬菌体,有直径55nm的二十面体头部,末端有细长尾丝。基因组为48.5 kb的线性双链DNA分子,有黏性末端即单链延伸12个核苷酸,感染后线性基因组可立即环化。噬菌体的头部由D蛋白和V蛋白构成,可以构建D蛋白和V蛋白的展示系统。λ噬菌体是在宿主细胞内完成装配的,无需将外源肽或蛋白分泌到细菌胞膜外,可展示有活性的大分子蛋白质(100 kDa以上蛋白质)及宿主细胞有毒性的蛋白质,适用范围极广。
3. T4噬菌体展示系统
T4 噬菌体基因组DNA 为双链线形,呈环状排列,噬菌体衣壳的有两种非必需外壳蛋白:SOC(small outer capsid protein)和HOC(highly antigenic outer capsid protein)。T4 噬菌体表面展示是将外源多肽或蛋白质分别与SOC位点的C末端和HOC 位点的N末端融合而展示于T4 噬菌体表面。T4噬菌体的主要优点是可以实现SOC位点和HOC位点同时展示,展示的拷贝数也较多。
4. T7噬菌体展示系统
T7 噬菌体基因组为线性双链DNA,其衣壳蛋白通常有两种形式,即10A(344个氨基酸残基)和10B(397个氨基酸残基),10B衣壳蛋白区存在于噬菌体表面,所以被用来构建噬菌体展示系统。T7噬菌体展示系统可以高拷贝展示50个氨基酸的多肽,以低拷贝量(0.1-1/噬菌体)或以中拷贝量(5-15/噬菌体)展示1200个氨基酸残基的多肽或蛋白质。因此,广泛应用于筛选不同分子量,不同亲和力的蛋白质。
三、噬菌体展示技术的应用
1. 抗体筛选
将抗体可变区的基因插入噬菌体基因组中,表达的抗体展示到噬菌体的表面,构建噬菌体展示抗体库,可以在体外模拟抗体生成的过程,筛选针对任何抗原的抗体。相对于杂交瘤技术,通过噬菌体展示抗体库技术筛选抗体,可以不经过免疫,缩短抗体生产的周期。也可以筛选在体内免疫原性弱,或者有毒性的抗原的抗体,适用范围广。噬菌体展示抗体库技术不受种属的限制,可以构建各种物种的抗体库。从人天然库中筛选到的抗体,可以不经过人源化过程,直接用于抗体药物研究。
2. 新受体和配体的发现
将随机多肽序列展示到噬菌体的表面,获得噬菌体展示多肽库。用细胞作为筛选靶标,经过差异筛选,获得出识别特定细胞的多肽。通过研究该多肽序列,可以进一步得到细胞表面特异性表达的受体蛋白。用HCT116细胞筛选12肽库,从库中筛选出了可以特异性行识别结肠癌细胞的多肽。进一步分析分析发现,该多肽可以特异性识别a-enolase。该蛋白有望作为结肠癌治疗的靶标,筛选结肠癌治疗药物。获得的多肽序列,也可以作为抗癌药物的运送载体。
3. 蛋白质相互作用研究
蛋白质的相互作用是生命过程中所不可缺少的,噬菌体展示的多肽文库是由特定长度的随机短肽序列组成。用靶蛋白质(如受体)对该随机文库进行亲和淘选,就可以获得与之结合的短肽序列。对所得序列测序分析,并合成相应的短肽,从而可以来研究两个蛋白质之间的相互作用。利用这种方法已经成功鉴定出多个重要大分子,如生长激素受体、胰岛素受体、胰岛素样生长因子受体和TNF-a 受体的激动剂和颉颃剂等。
4. 抗原表位分析
用抗体作为筛选的蛋白,从噬菌体展示的随机多肽库中,筛选出可以与抗体特异性结合的噬菌体,经测序分析,获得该抗体识别的抗原表位。该技术为抗原抗体反应机制研究,诊断试剂开发,疫苗制备等提供依据。
目前的表位鉴定技术能够实现:
①单抗药物及诊断用单抗的制备;
②研制包括“通用”目标在内的治疗性和预防性重组多价肽疫苗;
③研制单表位或重组多表位肽检测抗原;
④筛选基于表位基序的疾病、肿瘤等新的特异诊断标志物;
⑤高通量发现同源蛋白中全部保守性和特异性表位;
⑥筛选功能性抗体表位或者抗体中和性及可及性表位;
⑦为表位水平分析病毒遗传进化和变异,提供抗原漂移和转移的直接证据。
5. 抗体人源化改造
单抗人源化比例不断升高,单抗的药物靶位逐渐多样化,除了传统的细胞表面抗原,还包括了常见的细胞因子,部分研制中的单抗药物甚至可以识别多个抗原表位,而且单抗药物的结构也不限于完整的单抗分子。联合小分子等的治疗方案逐渐增加,日益受到医疗工作者的重视。因此,作为一种高科技含量的药物,单抗药物企业的科技水平决定了其竞争力,也决定了药物的治疗效果和市场价值。
6. 双特异性抗体(BsAb)制备
通过基因工程手段将两个分别靶向不同抗原的抗体片段组合在一起,具有两种抗原结合位点,可以发挥协同作用,进而提高治疗效果。但是双特异性抗体的种类较多,选择时根据最终的应用来做判断。
7. 酶抑制剂筛选
β- 酮脂酰-ACP 还原酶是原核生物脂肪酸生物合成代谢中高度保守和广泛存在的酶,用此蛋白为筛选的靶蛋白,从噬菌体肽库中筛选出了该酶的抑制剂,可以作为新型的抗菌剂。已针对乙酰胆碱酯酶、海藻糖酶、乙酰乳酸合成酶、乙酰CoA 羧化酶和谷氨酰胺合成酶等靶标酶,开发和研制了一系列高效的杀虫剂和除草剂。
8. 蛋白质的定向改造
蛋白质的定向改造是指用盒式突变、错误倾向PCR等方法来突变蛋白质或者结构域的某一特定编码序列,产生蛋白质或结构域的突变文库呈现在噬菌体表面,通过亲和筛选获得所需的已定向改变的噬菌体克隆,他们的一级结构可以从DNA的序列中推导出来,可用来筛选具有更强受体结合能力的细胞因子、新的酶抑制剂、转录因子的DNA结合新位点、新的细胞因子拮抗剂、新型酶和增强生物学活性的蛋白质等。
四、参考文献
1. Azzazy, H. M. and W. E. Highsmith, Jr. (2002). Phage display technology: clinical applications and recent innovations. Clin Biochem 35(6): 425-445.
2. Dai, M., J. Temirov, et al. (2008). Using T7 phage display to select GFP-based binders. Protein Eng Des Sel 21(7): 413-424.
3. Dunn, I. S. (1995). Assembly of functional bacteriophage lambda virions incorporating C-terminal peptide or protein fusions with the major tail protein. J Mol Biol 248(3): 497-506.
4. Kristan, K., T. Bratkovic, et al. (2009). Novel inhibitors of beta-ketoacyl-ACP reductase from Escherichia coli. Chem Biol Interact 178(1-3): 310-316.
5. Pande, J., et al. (2010).Phage display: concept, innovations, applications and future.Biotechnol Adv 28(6): 849-858.
6. Paschke, M. (2006). Phage display systems and their applications. Appl Microbiol Biotechnol 70(1): 2-11.
7. Ren, Z. J., G. K. Lewis, et al. (1996).Phage display of intact domains at high copy number: a system based on SOC, the small outer capsid protein of bacteriophage T4. Protein Sci 5(9): 1833-1843.
8. Smith, G. P. (1985).Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface. Science 228(4705): 1315-1317.
9. Sun, S., K. Kondabagil, et al. (2008). The structure of the phage T4 DNA packaging motor suggests a mechanism dependent on electrostatic forces. Cell 135(7): 1251-1262.
10. Wu, C. H., et al. (2015). alpha-Enolase-binding peptide enhances drug delivery efficiency and therapeutic efficacy against colorectal cancer. Sci Transl Med 7(290): 290ra291.
11. Yang, F., P. Forrer, et al. (2000). Novel fold and capsid-binding properties of the lambda-phage display platform protein gpD. Nat Struct Biol 7(3): 230-237.